Original web-page: http://employees.csbsju.edu/hjakubowski/classes/ch250/ROBI_CellTutorial.html
Vías metabólicas
Henry Jakubowski
Probablemente has estudiado la célula muchas veces, ya sea en la escuela secundaria o en las clases de biología de la universidad. Hay muchos sitios web disponibles que revisan tanto las células procariotas (bacterianas), arqueológicas y eucariotas (ver enlaces en la parte inferior). Este tutorial está diseñado específicamente desde el punto de vista de la química. Explora cuatro clases de biomoléculas (lípidos, proteínas, ácidos nucleicos y carbohidratos) y describe de manera ilustrada y simplificada dónde se encuentran, fabrican y degradan en la célula (es decir, su historia). Se centra en las células eucariotas, que a diferencia de las células procariotas más simples, tienen orgánulos internos rodeados de membranas que compartimentan las reacciones químicas. Primero se presenta una descripción general de la célula. Los capítulos posteriores se concentrarán en biomoléculas específicas.
Pensemos en una célula como una fábrica química que diseña, importa, sintetiza, utiliza, exporta y degrada una variedad de productos químicos (en el caso de las células, estos incluyen lípidos, proteínas, ácidos nucleicos y carbohidratos). También debe determinar o detectar la cantidad de productos químicos crudos y terminados que tiene disponibles y responder a sus necesidades propias y externas aumentando o cerrando la producción. La figura de la celda a continuación y en otros sitios vinculados basada en ella se puso a disposición con el amable permiso de Liliana Torres. Haga clic en el hipervínculo azul s para algunos de los orgánulos de información más detallada sobre ellos.
Figura: Una célula eucariota
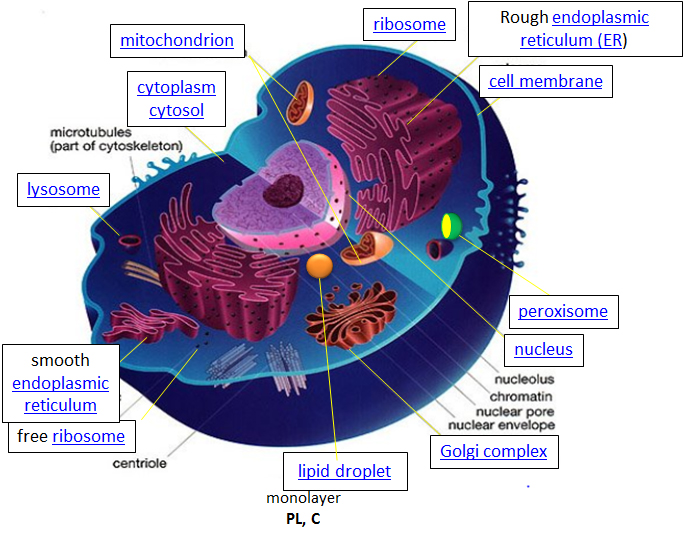
http://torresbioclan.pbworks.com/w/page/22377234/Spikefish%20About%20Cells
Usar con permiso de Liliana Torres . También en http://www.animalport.com/animal-cells.html
Diseño – el diseño de una célula reside principalmente en el plano de la célula, el código genético, que se compone del ADN en el núcleo celular y una pequeña cantidad en las mitocondrias. Por supuesto, el modelo de ADN debe ser leído (transcrito) por enzimas de proteínas que fueron codificadas por el ADN. El código genético tiene el plan maestro que determina la secuencia de todas las proteínas celulares, que luego catalizan casi todas las demás actividades en la célula, incluida la catálisis, la motilidad, la estructura arquitectónica, etc. A diferencia de los polímeros de ADN, Ácido ribonucleico y proteínas, la longitud y La secuencia de un polímero de polisacárido no está impulsada por una plantilla, sino por las enzimas que catalizan la polimerización.
Importar/exportar: Muchos de los componentes químicos de la célula surgen no de la síntesis directa sino de la importación de moléculas pequeñas y grandes. Las moléculas importadas deben pasar a través de la membrana celular y, en algunos casos, a través de membranas adicionales si necesitan residir dentro de orgánulos unidos a la membrana. Las moléculas pueden moverse hacia la célula por difusión pasiva a través de la membrana, pero generalmente su movimiento es “facilitado” por un receptor de membrana. Las moléculas también pueden subir un gradiente de concentración en un proceso llamado “transporte activo”. Dada la naturaleza anfifílica de la bicapa (exterior del grupo de cabeza polar, interior no polar), es de esperar que una molécula polar como la glucosa tenga dificultades para moverse a través de la membrana. De hecho, las proteínas de transporte de membrana están involucradas en el movimiento de las moléculas no polares y polares.
– transportadores, proteínas portadoras y permeasas: Estas proteínas de membrana se mueven las moléculas de ligando específico través de una membrana, típicamente por un gradiente de concentración. Las simulaciones por ordenador de la difusión facilitada de lactosa través de la membrana se muestran en el siguiente enlace. Animación de difusión lactosa a través del receptor LacY
(El enlace de arriba e inmediatamente a continuación son de la Teórica y computacional biofísica grupo en el Instituto Beckman, Universidad de Illinois en Urbana-Champaign. Estas simulaciones de dinámica molecular se hicieron con otro apoyo VMD/NAMD/BioCoRE/JMV/software desarrollado por el grupo con el apoyo de los NIH.)
– los canales de iones – Estas proteínas de la membrana permiten el flujo de iones a través de membranas. Algunos son permanentemente abierta (nongated) mientras que otros son cerradas abierta o cerrada dependiendo de la presencia de ligandos que se unen el canal de la proteína y el medio ambiente local de la proteína en la membrana. Flujo de iones a través de las ganancias de canal en una dirección favorecida termodinámicamente, que depende de su concentración y tensión gradientes través de la membrana.
– poros: Algunas membranas (nuclear, mitocondrias) se ensamblan las proteínas (tales como porinas) para formar grandes, pero los poros regulados. Porins se encuentran en las membranas mitocondriales mientras nucleoporins se encuentran en la membrana nuclear. Las moléculas pequeñas pueden pasar generalmente a través de estos poros de la membrana mientras que las grandes uno se selecciona en base a su tendencia a formar fuerzas de atracción intermoleculares transitorios con las proteínas de los poros. Los siguientes enlace muestra la difusión de agua a través de acuaporina. animación de la difusión del agua a través del canal de acuaporina,
– endocitosis: partículas muy grandes (por ejemplo, LDL o lipoproteínas o virus de Baja Densidad) pueden entrar a una célula mediante un proceso denominado endocitosis. Inicialmente, el LDL o virus se une a un receptor en la superficie de la célula. Esto desencadena una serie de eventos que conduce a la invaginación de la membrana de la célula en ese punto. Esto a la larga pellizca para formar un endosomal vesícula que está rodeado por una proteína llamada clatrina. endosomas “temprano” pueden recoger nuevas proteínas y otros componentes, así como arrojar ellos a medida que se mueven y maduran a través de la célula. Durante este proceso de maduración, las bombas de proteína en el plomo endosoma a una disminución en el pH endosomal que puede conducir a cambios de conformación en la estructura de proteínas y derramamiento de proteínas. Finalmente, los “tarde” endosoma alcances y se fusiona con el lisosoma, un orgánulo interna que contiene enzimas de degradación. componentes no degradadas como los ácidos nucleicos virales o colesterol, se entregan a la célula. Este transporte también puede ir en los receptores de dirección y reciclar inversa a la membrana celular. Asimismo vesículas pellizcado fuera desde el fusible puede complejo de Golgi con endosomas, con algunos componentes que sobrevivieron el proceso de volver a entrar en el aparato de Golgi.
Sintetizar/degradar: las células deben sintetizar y degradar moléculas pequeñas, así como proteínas poliméricas, carbohidratos y ácidos nucleicos más grandes. Las vías anabólicas (sintéticas) y catabólicas (degradativas) a menudo están compartimentadas en el tiempo y el espacio dentro de una célula. Por ejemplo, la síntesis de ácidos grasos se lleva a cabo en el citoplasma, pero la oxidación de ácidos grasos se lleva a cabo en las mitocondrias. Las proteínas se sintetizan en el citoplasma o se completan en el retículo endoplásmico (para proteínas de membrana y exportadas) mientras se degradan en el lisosoma o, lo que es más importante, en una gran estructura multimolecular en la célula llamada proteasoma.
Consideremos algunas características clave de una celda antes de entrar en detalles.
Las células y sus compartimentos internos tienen concentraciones reguladas de iones e iones hidronio.
Como era de esperar, el pH del citosol (la sustancia acuosa que rodea todos los orgánulos dentro de la célula) varía de aproximadamente 7,0 a 7,4, dependiendo del estado metabólico de la célula. Algunos orgánulos tienen transportadores de protones que pueden alterar significativamente el pH dentro de un orgánulo. Por ejemplo, el pH dentro del lisosoma, un orgánulo degradante, es de aproximadamente 4,8. El colapso del gradiente de pH a través de la membrana mitocondrial interna es suficiente para impulsar la síntesis termodinámicamente desfavorable de ATP.
En comparación con el fluido extracelular, la concentración de iones de potasio es mayor dentro de la célula, mientras que las concentraciones de iones de sodio, cloruro y calcio son más altas en el exterior de la célula (ver la tabla a continuación). Estos gradientes de concentración son mantenidos por transportadores de iones y canales y requieren un gasto de energía en última instancia en forma de hidrólisis de ATP. Los cambios en estas concentraciones son parte integral del sistema de señalización utilizado por la célula para detectar y responder a los cambios en sus entornos externos e internos.
El agua se encuentra en forma masiva, así como unida a macromoléculas como proteínas y polisacáridos. Se esperaría que estas aguas tengan diferentes propiedades. La siguiente tabla muestra las concentraciones aproximadas de iones en la célula.
| Ion | Dentro (mM) | Fuera (mM) |
| Na+ | 140 | 5 |
| K+ | 12 | 140 |
| Cl- | 4 | 15 |
| Ca2+ | 1 uM | 2 |
Las celdas tienen un marco interno que proporciona soporte arquitectónico y estructural interno.
La arquitectura “citoesquelética” de una (con estructuras de “cordones” moleculares y “tipo viga”) no es diferente de una fábrica.

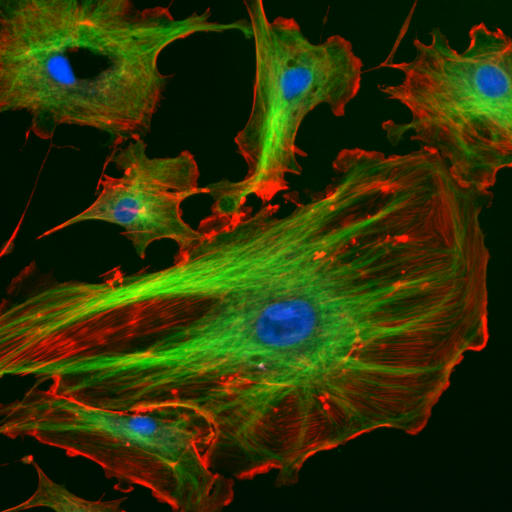
http://www.cybercom.net/~copters/trips/pictures/factory_inside.jpg http://en.wikipedia.org/wiki/File:FluorescentCells.jpg
El marco interno o citoesqueleto de una célula, se compone de microfilamentos, filamentos intermedios, y los microtúbulos. Estos están compuestos de proteínas monoméricas que autoensamblarse para formar la arquitectura interna. Piezas del citoesqueleto se pueden ver en la foto de arriba (tomado de Wikipedia).
En la imagen se muestran microfilamentos de monómeros de actina (que están teñidos con un fluoróforo rojo/naranja) y microtúbulos que ofrecen más soporte estructural hecho de monómeros de tubulina (teñidos de verde) junto con el núcleo teñido de azul. Los orgánulos son compatibles y organizados por el citoesqueleto (principalmente microtúbulos). Incluso la membrana celular está soportada debajo de la valva interna por actina (naranja teñida) y microfilamentos de espectrina. Las proteínas motoras como la miosina (que se mueve a lo largo de los microfilamentos de actina) y la dineína y la kinesina (que se mueven a lo largo de los microtúbulos de tubulina) transportan carga (vesículas, orgánulos) de forma direccional. La célula no es una colección desorganizada de moléculas y orgánulos. Más bien es un producto altamente organizado para una producción, uso y degradación químicos óptimos.
Las células tienen una variedad de formas. Algunas células inmunes circulantes deben deslizarse a través de las células que recubren las paredes capilares para migrar a los sitios de infección. El mismo proceso ocurre cuando las células tumorales hacen metástasis y escapan a otros sitios del cuerpo. Para hacerlo, la célula debe cambiar drásticamente la forma, una respuesta que requiere la disociación de los polímeros del citoesqueleto en monómeros que están disponibles más tarde para la repolimerización.
La celda es un lugar increíblemente lleno de gente.
En los laboratorios de química, por lo general trabajo con soluciones diluidas de moléculas de soluto en un disolvente. Usted probablemente ha escuchado que el cuerpo está compuesto de agua 68%, pero la concentración de agua es, obviamente, depende del entorno celular. moléculas de soluto como proteínas y carbohidratos están densamente empaquetados. Las células se tan lleno que el espacio entre las moléculas más grandes, como la proteína es menor que el tamaño de la proteína. Los estudios han demostrado que la estabilidad de una proteína se incrementa en tal condición, lo que ayudaría a mantener la proteína en estado plegado, nativa. Otra consecuencia de las altas concentraciones es que sería promover la agregación de unión o auto de moléculas similares, así como los aversión que desde una perspectiva de equilibrio no ocurrirían en soluciones diluidas. in vivo. Recientemente investigadores han añadido un copolímero neutro de sacarosa y epiclorhidrina a las células in vitro. Estas partículas inducidos organización de las moléculas extracelulares secretadas por la célula, formando un extracelular “matriz” organizada que indujo la organización de los microfilamentos en el interior de la célula, así como la inducción de cambios en la actividad celular.1 in vitro la actividad enzimática de una enzima clave en la glucólisis aumenta drásticamente en condiciones de hacinamiento.2 Otro resultado de la aglomeración puede ser la asociación espacial y temporal de las enzimas clave en las rutas metabólicas específicas, permitiendo la difusión más fácil de sustratos y los productos de las enzimas colocalized.
Figura: El citoplasma lleno de E. Coli – Ufrom McGuffee SR, Elcock AH (2010) PLoS Comput Biol 6 (3): e1000694. doi: 10.1371/journal.pcbi.1000694 (Diario de código abierto)
La simulación por computadora utilizó 50 tipos diferentes de las macromoléculas más abundantes del citoplasma de E. coli y 1008 moléculas individuales. Representación del modelo de citoplasma al final de una simulación dinámica. El ácido ribonucleico se muestra en verde y amarillo. Esta figura fue preparada con VMD
Los componentes celulares experimentan transiciones de fase para formar subestructuras dentro de la célula.
Una pregunta desconcertante es cómo se forman las subestructuras dentro de una celda. Esto incluye no solo la biogénesis de orgánulos como las mitocondrias, sino también partículas más pequeñas, como gránulos de polisacárido, gotas de lípidos, partículas de proteína/ácido ribonucleico (incluido el ribosoma), así como el núcleo del núcleo de la célula. Puede ser más fácil considerar este problema utilizando dos ejemplos del mundo de los lípidos, las gotas de lípidos y las balsas de membrana. Usted está muy familiarizado con las transiciones de fase que ocurren cuando se agrega un líquido no polar soluble escaso al agua. A una concentración suficientemente alta, se excede la solubilidad del líquido no polar y se produce una transición de fase, como lo demuestra la aparición de dos fases líquidas separadas. El mismo proceso ocurre cuando los triglicéridos se unen en gotas de lípidos con proteínas asociadas en su exterior. Otro ejemplo ocurre dentro de una membrana celular cuando los lípidos con cadenas alquílicas saturadas se autoasocian con el colesterol de la membrana (que contiene un sistema de anillo plano rígido) para formar una balsa lipídica caracterizada por una mayor eficiencia de empaquetamiento, rigidez y grosor que otras partes de la membrana. Estas balsas lipídicas a menudo reclutan proteínas involucradas en los procesos de señalización dentro de las membranas celulares. Este proceso de separación de fases también se denomina desmezcla líquido/líquido, ya que dos sustancias “similares a un líquido” se separan.
Parece que las proteínas que interactúan con el ácido ribonucleico están compuestas de aminoácidos menos diversos y tienen estructuras más flexibles (“más líquidas”) que permiten su interacción preferencial con el Ácido ribonucleico para formar grandes partículas de proteína del ácido ribonucleico (como el ribosoma y otras estructuras de procesamiento de ácido ribonucleico) de una manera que imita la mezcla líquida/líquida. Todas estas interacciones son solo manifestaciones de las diversas fuerzas intermoleculares que estudiaste en las clases de química anteriores.
Has estudiado la estructura de lípidos, proteínas, ácidos nucleicos y carbohidratos en las clases introductorias de biología y/o química. Ahora siga los siguientes enlaces que lo llevarán a los capítulos del guia celular que muestran la historia de vida de este tipo de moléculas en la célula.
- CT0- L. La célula: Lípidos
- CT0-P. La célula: Proteínas
- CT0 – N. La célula: Ácidos nucleicos
- CT0 – C. La célula: carbohidratos
Una lista de sitios web y applets sobre la estructura de las células eucariotas:
- Tutorial celular de la UCLA
- Planta y simulación de células animales (requiere Java)
- Descargar Apple Store Applet para iPad, iTouch, iPhone: Cell 3D
Referencias:
1. Zeiger AS, Loe FC, Li R, Raghunath M, Van Vliet KJ (2012) Macromolecular Crowding Directs Extracellular Matrix Organization and Mesenchymal Stem Cell Behavior. PLoS ONE 7(5): e37904. doi:10.1371/journal.pone.0037904 .
2. Apratim Dhara, Antonios Samiotakisb, Simon Ebbinghausa, Lea Nienhausa, Dirar Homouzb, Martin Gruebelea, and Margaret S. Cheungb. Structure, function, and folding of phosphoglycerate kinase are strongly perturbed by macromolecular crowding. Proc. Natl Acad Sci. www.pnas.org/cgi/doi/10.1073/pnas.1006760107
3. Anthony A. Hyman and Kai Simons. Beyond Oil and Water–Phase Transitions in Cells. Science 337, 1047 (2012); DOI: 10.1126/science.1223728
4. McGuffee SR, Elcock AH (2010) Diffusion, Crowding & Protein Stability in a Dynamic Molecular Model of the Bacterial Cytoplasm. PLoS Comput Biol 6(3): e1000694. doi:10.1371/journal.pcbi.1000694
Esta página fue escrita y mantenida por Henry V. Jakubowski, Ph.D., Colegio de Saint Benedict/Saint John’s University. Estos materiales están disponibles para uso educativo.
Este material se basa en el trabajo apoyado por la Fundación Nacional de Ciencia bajo Grant No. 1043566.
Las opiniones, hallazgos y conclusiones o recomendaciones expresadas en este material son de los autores y no reflejan necesariamente los puntos de vista de la Fundación Nacional de Ciencia.
© 2020 Dr. Henry Jakubowski

 Atomska teorija Daltona
Atomska teorija Daltona
 x O2 + Cx (H2O) y
x O2 + Cx (H2O) y















