Original: http://www.tulane.edu/~wiser/protozoology/notes/aids.html
Mark F. Wiser
AIDS, ili sindrom stečene imunodeficijencije, imao je veliki utjecaj na nekoliko bolesti uzrokovanih protozoanskim patogenima. Etiološki agens AIDS-a je retrovirus nazvan virus humane imunodeficijencije (HIV). Retrovirusi su jednolančani RNA virusi sa omotačem. Nakon infekcije ćelije, enzim kodiran virusom – nazvan reverzna transkriptaza ili DNK polimeraza zavisna od RNK – kopira RNA genom u DNK koja je integrisana u genom ćelije domaćina. Kopije virusnog genoma i mRNA se transkribiraju iz integriranog retrovirusa, a rezultirajući virusni proteini se sastavljaju s RNA genomom u virusne čestice koje pupaju iz ćelije domaćina.
Ćelijski receptor za HIV je CD4-antigen i ko-receptor iz porodice b- hemokina (npr. CXCR4, CCR5). Sve T-pomoćne ćelije eksprimiraju CD4 na svojoj površini, kao i mnogi makrofagi i monociti i neki B-limfociti. Najočigledniji patološki efekat HIV infekcije je smanjenje broja i efikasnosti CD4+ T-limfocita. Dijagnoza AIDS-a se definiše kao pozitivna na HIV antitijela i broj CD4+ T-limfocita ispod 200 po mm3 ili manji od 14% ukupnih limfocita. Ovi efekti na različite imunološke efektorske ćelije, a posebno na CD4+ T-limfocita, dovode do opšteg neuspjeh ćelije posredovane reakcije imunog, i na taj način, dovesti do niza oportunističkih infekcija. Ovaj oportunizam može se prikazati kao:
- infekcije organizmima koji su rijetko patogeni
- povećana težina ili trajanje bolesti
- crijevne kokcidije (Cryptosporidium, Cyclospora, Isospora)
Pieniazek ostalo (1999)
Nastajuće zarazne bolesti 5:444# genotip 5 genotip 1 (ljudi)* 1 genotip 2 (goveda)* 3 Cryptosporidium felis 1 Cryptosporidium sp. (pas)
*Genotipovi 1 i 2 prethodno definisani (vidi Cryptosporidium).
- Toksoplazmatski encefalitis
- Leishmania infantum: dermotrofni sojevi izazivaju visceralne bolesti (vidi dolje)
- crijevne kokcidije (Cryptosporidium, Cyclospora, Isospora)
Imuni sistem efikasno eliminiše ili kontroliše većinu potencijalno zaraznih organizama. AIDS i druga imunokompromitirajuća stanja će uticati na ravnotežu između patogena i domaćina i omogućiti organizmima da se repliciraju na nivoe koji su viši od normalnog, stvarajući tako težu bolest. Imunosupresija povezana sa AIDS-om također omogućava nekim organizmima, koji inače ne bi mogli efikasno uspostaviti infekciju kod ljudi, da izazovu bolest. Na primjer, u jednoj studiji mala podjedinica rRNA je sekvencionirana iz kriptosporidija 10 nasumično odabranih HIV pacijenata. Skoro polovina genotipova bila je iz Cryptosporidium koji se normalno povezuje sa kućnim ljubimcima (Tabela, Pieniazek).
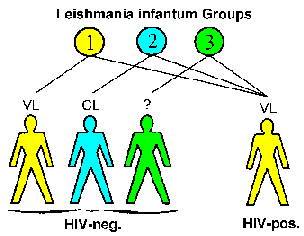
AIDS može uticati i na kliničke manifestacije. Na primjer, opisane su tri različite etiološke grupe, koje se također mogu razlikovati po zymodemima, Leishmania infantum: grupa 1 obično izaziva visceralnu bolest, grupa 2 kožnu leziju, a grupa 3 ne uzrokuje bolest. Kod osoba zaraženih HIV-om, sve tri grupe uzrokuju viseralnu bolest (slika) što ukazuje da normalno dermotropni sojevi mogu postati viscerotropni.
Postoje ili kontradiktorni rezultati ili ograničeni očigledni učinci ko-HIV infekcije povezane s Plasmodium, Entamoeba histolytica, Giardia, Trichomonas vaginalis i Trypanosoma infekcije. Ovaj nedostatak jasnih asocijacija mogao bi se dijelom objasniti malim razlikama između HIV-negativnih i HIV-pozitivnih pojedinaca, za razliku od otvorenih razlika uočenih kod oportunističkih infekcija o kojima je gore raspravljano. Na primjer, rezultati ugandske studije koja je uključivala 484 učesnika koji su obavili 7220 posjeta klinici između 1990. i 1998. pokazali su povećanu učestalost kliničke malarije i parazitemije povezanih sa HIV-1 infekcijom (Tabela, Whitworth). Nadalje, manji broj CD4-ćelija bio je povezan s povećanom gustoćom parazita i povećanim rizikom od kliničke malarije. Ovi rezultati bi mogli imati važne implikacije na javno zdravlje kada se uzme u obzir prevalencija i HIV-a i malarije u podsaharskoj Africi.
Epidemiološke studije također sugeriraju da je malarija smrtonosni
| Whitworth ostalo (2000) Lancet 356:1051 |
|||||||||
|---|---|---|---|---|---|---|---|---|---|
|
kofaktor za AIDS. Na primjer:
- progresija od HIV-pozitivnosti do pokazivanja AIDS-a je otprilike 5 godina – polovina normalnog vremena progresije – u podsaharskoj Africi
- Pojedinci zaraženi HIV-om pogoršavaju se brže sa svakom epizodom malarije
- dojenčad rođena od majki koje su istovremeno zaražene HIV-om i malarijom imaju 4 puta veću stopu smrtnosti od dojenčadi rođenih od majki zaraženih HIV-om ili samo malarijom.
Zanimljivo je da in vitro studije pokazuju da CD4-ćelije stimulirane malarijskim antigenima pokazuju 30-100 puta povećanje virusnog opterećenja.
Pneumocystis carinii Pneumonija (PCP)
Pneumocistis su gotovo istovremeno opisali Chagas 1909. i Carini 1910. Prvi
| Pneumocistis kao gljiva |
|---|
Zid ciste
16S-rRNA
DHFR i TS
Faktor izduženja 3
|
put je prepoznat kao ljudski patogen u vezi sa institucionalnim (tj. sirotištima) epidemijama među pothranjenom dojenčadi i djecom tokom i nakon Drugog svjetskog rata. U nedavnoj prošlosti i trenutno to je česta i ozbiljna oportunistička infekcija povezana sa AIDS-om. Prije široke upotrebe profilakse, PCP je bila bolest koja je definirala AIDS u 60% slučajeva i na kraju je zahvatila 80% pacijenata sa AIDS-om.
Istorijski gledano, Pneumocystis je bio neizvjesnog taksonomskog statusa da li je protozoa ili gljiva. Molekularni podaci ukazuju da se vjerovatno radi o gljivama nalik na askomicete bez ekstremno bliskih srodnika (Stringer, 1993; Nastajuće zarazne bolesti 2:109). Do sličnih zaključaka dolazilo se ranije na osnovu ultrastrukturnih studija (Varva i Kučera, 1970; J. Protozol. 17:463). Analiza DNK pokazuje da Pneumocystis izolirani od različitih vrsta domaćina imaju vrlo različite sekvence DNK. Kao priznanje ove genetske posebnosti, predloženo je da se preimenuje Pneumocystis izolovan od ljudi P. jirovecii (Stringer ostalo, 2002, Nastajuće zarazne bolesti 8:891).
Životni ciklus i prijenos
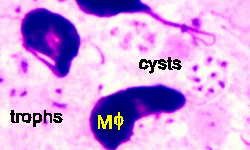
Životni ciklus pneumocistisa nije poznat. Tri morfološka oblika (slika) su opisana u plućnim alveolama: trofozoit, cista i intracistična tijela. Trofozoit je prečnika 2-6 µm i ima pseudopodije. Pretpostavlja se da se ovaj trofični oblik replicira binarnom fisijom i sposoban je da se razvije u cistu. Cista ima debeo zid koji je obojen metenamin-srebrom i prečnika je 4-7 µm. Unutar ciste se nalazi do 8 intracističnih tijela (1-1,5 µm). Ovi ‘zoiti’ se oslobađaju nakon rupture zida ciste i vjerovatno se razvijaju u trofozoite. Seksualna replikacija je pretpostavljena, ali nije jasno kada se to događa.
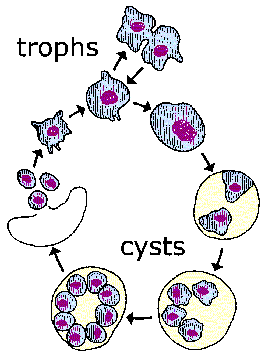 Način prenošenja nije poznat, ali se pretpostavlja da je udisanjem cista (ili drugim infektivnim stadijumom). Prenos zračnim putem je dokazan kod pacova i najvjerovatniji je mehanizam za prijenos na ljude. Reaktivacija latentnih infekcija dugo se smatrala primarnim objašnjenjem PCP-a kod imunokompromitovanih osoba. Međutim, noviji podaci pružaju snažne posredne dokaze za aktivno sticanje infekcije (Beard et al, 2000; Nastajuće zarazne bolesti 6:265). Ova zapažanja uključuju:
Način prenošenja nije poznat, ali se pretpostavlja da je udisanjem cista (ili drugim infektivnim stadijumom). Prenos zračnim putem je dokazan kod pacova i najvjerovatniji je mehanizam za prijenos na ljude. Reaktivacija latentnih infekcija dugo se smatrala primarnim objašnjenjem PCP-a kod imunokompromitovanih osoba. Međutim, noviji podaci pružaju snažne posredne dokaze za aktivno sticanje infekcije (Beard et al, 2000; Nastajuće zarazne bolesti 6:265). Ova zapažanja uključuju:
- nekoliko izvještaja o grupama PCP slučajeva
- studije koje sugeriraju da je latentni period ograničen (< jedne godine)
- naknadne infekcije pokazuju jedinstvene genotipove
Nadalje, visoke stope seropozitivnosti u normalnim populacijama i brze stope u kojima se novorođenčad inficira, a pacijenti sa AIDS-om ponovno inficiraju nakon uspješnog liječenja, sugeriraju da je pneumocistis organizam koji se često sreće. U ovom trenutku nije jasno da li je izvor direktan (tj. od osobe do osobe) ili indirektan (tj. okoliš). Jedna studija (Medrano et al, 2005; Nastajuće zarazne bolesti 6:245 ) sugerira da ljudi mogu biti rezervoar za prijenos infekcije. Što se tiče indirektnog prijenosa, može se pretpostaviti dimorfna gljiva (tj. hife naspram oblika kvasca) koja još nije identificirana ili okarakterizirana iz izvora okoliša. Glavni faktor rizika za dobijanje bolesti je defektan ćelijski posredovan imunitet (npr. CD4+ Broj T-limfocita <200/mm3).
Patogeneza i simptomi
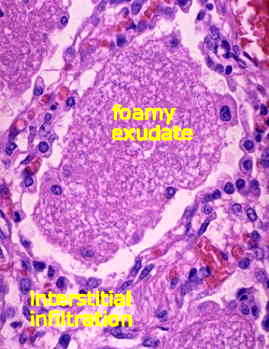
Pneumocistis je ekstracelularni patogen koji proizvodi intersticijsku pneumoniju plazma ćelija (upala pluća). ‘Intersticijal’ se odnosi na zadebljanje aveolarnih septa zbog infiltracije plazma ćelija (tj. limfocita), koje mogu napredovati do fibroznih. Osim toga, alveole se pune pjenastim vakuoliziranim materijalom (slika). Alveole se nastavljaju puniti ovim materijalom kako bolest napreduje, a smrt je posljedica progresivne afiksije (tj. gušenja).
Klinički simptomi PCP-a su:
- otežano disanje, dispneja (otežano disanje)
- suhi neproduktivni kašalj (ali pušači imaju tendenciju da proizvode malo sputuma)
- vrućica
- umor, malaksalost
- noćno znojenje
- cijanoza
Dispneja, neproduktivni kašalj i groznica predstavljaju klasičnu trijadu simptoma uočenih u otprilike 50% slučajeva, pri čemu gotovo svi pacijenti imaju dva od ovih simptoma. Simptomi imaju tendenciju da napreduju polako tokom nedelja do meseci i često se primećuje dugotrajna, progresivna dispneja pri naporu. Međutim, bolest može imati brži početak koji se javlja tokom nekoliko dana kod djece i odraslih bez imunosupresije na AIDS. Pacijenti koji nisu oboljeli od AIDS-a imaju tendenciju da budu prerano neuhranjena novorođenčad, iako se to može javiti kod normalne novorođenčadi bez dokaza imunodeficijencije. Opet, početak može biti suptilan i javiti se tokom nekoliko sedmica ili mjeseci karakteriziran neuspjehom u razvoju što dovodi do brzog disanja (do 100 udisaja u minuti) i konačno cijanoze. Ekstrapulmonalni (npr. srce, slezina, koža, oči) Pneumociza je rijetka, ali se češće prepoznaje. Vjerovatno diseminacija uključuje razbijanje endotelnih barijera u plućima.
Dijagnoza, liječenje i profilaksa
| PCP Dijagnoza | ||||||||
|---|---|---|---|---|---|---|---|---|
|
||||||||
|
||||||||
|
Definitivna dijagnoza PCP-a zahtijeva otkrivanje organizma u kombinaciji sa simptomima i faktorima rizika. Metode izbora za prikupljanje materijala su indukcija sputuma i bronhoalveolarna lavaža (BAL). Detekcija iz neiduciranog sputuma je niska zbog prianjanja organizama na alveolarne stanice. Inducirani test sputuma uključuje udisanje maglice fiziološkog rastvora i ispitivanje sputuma koji izlazi na Pneumocystis. BAL je invazivniji i skuplji, ali ima tendenciju da bude osjetljiviji (Tabela). Bronhoskop se ubacuje u pluća, a fiziološki rastvor se distribuira direktno u disajne puteve, a zatim se povlači. Ispiranje u dva ili više segmenata, posebno u gornjim režnjevima, uvelike povećava stopu detekcije. Zbog rizika, transbronhijalne biopsije se obično rade samo ako BAL nije uspio ili kada se sumnja na druge bolesti (npr. neoplazme, tuberkuloza, druge gljivične infekcije). Dijagnoza HIV-seronegativnih pacijenata je često teška jer oni obično imaju manje organizama i izraženiji upalni odgovor.
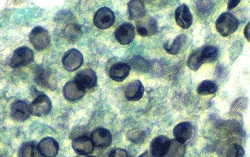
Gomorijeva metenamin srebrna boja je poželjna metoda za aspirate i biopsije. Zid ciste ima tamno sivu do crnu boju i lako se prepoznaje (slika). Preparati obojeni Giemzom izgledaju kao otvorena područja sa do osam tačaka (jezgra intracističnih tijela). Giemsa boji samo organizam, a ne i zid ciste, dok se samo zid ciste boji srebrom. Osim toga, pojedinačne slobodne tačke, vjerovatno jezgra trofozoita, također se mogu naći u cijelom uzorku obojenom po Giemsi (slika). Dijagnoza preparata obojenih po Giemsi je teška i zahtijeva veći nivo tehničke stručnosti. (Vidi Umjetnost citologiju Suzanne L. Adams za kompozitne boje olovka ilustracija različitih citološke karakteristike Pneumocystis, ili Webpath za dodatne slike patologije.)
Prvi izbor liječenja trimetoprim-sulfametoksazol (Bactrim) koji se daje intravenozno ili oralno. Pacijenti sa AIDS-om općenito zahtijevaju duže liječenje, pokazuju postojanost organizama i imaju više neželjenih reakcija na lijekove. Neuspjesi liječenja javljaju se u 10-20% vremena i često se javljaju neželjeni efekti lijekova, kao što su mučnina, povraćanje, osip i supresija koštane srži. Alternativni lijekovi uključuju: pentamidin (intravenozno ili aerosol), trimetreksat (Neutrexin) + folinska kiselina (Leucovorin), trimetoprim + dapson, klindamicin (Cleocin) + primquine ili Atovaquone (Mepron). U teškim slučajevima PCP-a preporučuje se istodobna primjena kisika. Osim toga, kortikosteroidi smanjuju rizik od respiratorne insuficijencije i smrti te umjerenog do teškog PCP-a. Prognoza za pacijente koji razvijaju respiratornu insuficijenciju je loša.
Započinjanje profilakse sa Batrimom za pacijente sa AIDS-om sa <200/mm3 CD4+ T-limfocita postalo je prihvaćena praksa. Ovaj pristup smanjuje razvoj PCP i produžava život. Bactrim profalaksa također smanjuje toksoplazmatski encefalitis povezan sa AIDS-om. Dapson i pentamidin u obliku aerosola (NubuPent) su alternative Bactrimu u slučaju neželjenih reakcija.
Za detaljniji pregled PCP dijagnostike i liječenja pogledajte:
Wilkin A and Feinberg J (1999) Pneumocystis carinii pneumonia: a clinical review. Am. Fam. Phys. 60:1699-1714.
Mikrosporidija
Mikrosporidije su obavezni intracelularni paraziti koji se nalaze u širokom spektru domaćina, ali najbrojniji kod insekata i riba. Prvi ih je opisao Louis Pasteur 1865. godine kada je identificirao spore Nosema bombycis kao uzročnika bolesti pebrina (aka, Flechenkrankheit) u komercijalno važnoj svilenoj bubi. Nedavno su epidemije Nosema apis izazvale ogromne gubitke medonosnih pčela širom svijeta. Ekonomski značaj pčela kao oprašivača procjenjuje se na 10 milijardi dolara godišnje.
Mikrosporidija pokazuje mnoge jedinstvene karakteristike i tradicionalno se smatra protozoama i daje im status tipa (Microspora). Međutim, molekularni podaci ukazuju da su oni bliži povezani s gljivama. Ovi podaci uključuju: umetak u faktoru elongacije-1alfa koji je jedinstven za gljive; odvojene proteine timidilat sintetaze (TS) i dihidrofolat reduktaze (DHFR); sekvence alfa- i beta-tubulina; i mitohondrijalnu HSP70 sekvencu. Također su značajni ribozomi slični prokariotima i rRNA sekvence koje ukazuju na drevnu lozu. Mikrosporidija je vjerovatno visoko derivirana gljiva s vrlo malim genomom (2,5 Mb) zbog značajnih genetskih i funkcionalnih gubitaka u usporedbi s drugim eukariotskim mikroorganizmima. Kako god, Liu ostalo, BMC Evol Biol 6:74, 2006.).
Morfologija i životni ciklus
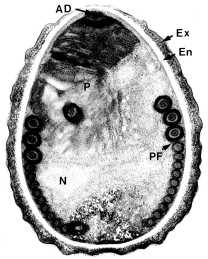
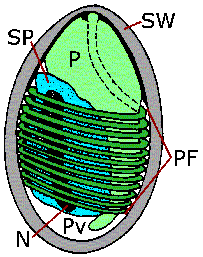
Primarna prepoznatljiva karakteristika mikrosporidija su male spore (1-3 µm) debelih zidova koje sadrže specijaliziranu organelu zvanu polarna cijev ili polarni filament (Slike). Zid spora se sastoji od debele egzospore bogate proteinima i hitinske endospore prozračne elektrone. Polarni filament je duga namotana struktura unutar spore koja se može otkriti samo elektronskim mikroskopom. Klijanje spora uključuje brzo istiskivanje polarnog filamenta sa prednjeg kraja spore. Ispražnjena polarna cijev može biti u dužini od 50-500 µm.
Organizam, koji se u ovoj fazi naziva sporoplazma, gura se niz dužinu ovog tubula i izlazi iz spore. Vjeruje se da struktura sastavljena od lamelarnih membrana, nazvana polaroplast, funkcionira u ekstruziji polarnog filamenta i formiranju plazma membrane sporoplazme u nastajanju. Kod nekih vrsta polarni filament je sposoban da prodre kroz plazma membranu ćelija domaćina omogućavajući mikrokrosporidiji da prođe direktno u citoplazmu ćelije domaćina. Alternativno, spore se mogu uzeti fagocitozom i polarna cijev se koristi za prodiranje kroz membranu fagolizosoma i tada sporoplazma dobiva pristup citoplazmi ćelije domaćina.
|
|
|
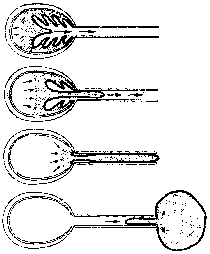 |
(Lijevo) Elektronski mikrosnimak spora mikrosporida koji prikazuje poprečne presjeke polarnog filamenta (PF). Ostale označene strukture su: pričvrsni disk (AD), polaroplast (P), egzospora (Ex), endospora (En), jezgro (N) i zadnja vakuola (Pv). Od T.G. Andreadis (Časopis za eukariotsku mikrobiologiju 41:147, 1994) (Centar) Šematski prikaz spora koji prikazuje sporoplazmu (SP), jezgro (N), polaroplast (P), polarni filament (PF), zadnju vakuolu (Pv) i zid spora (SW). (Desno) Šematski prikaz klijanja spora kako polaroplast formira plazma membranu sporoplazme u nastajanju i moguća uloga osmotskog pritiska.
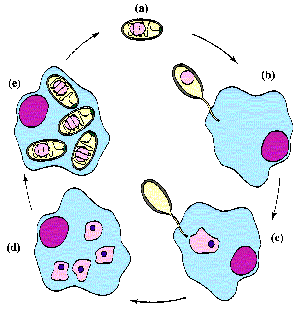
Životni ciklus mikrosporida sastoji se od tri različite faze: infektivnu, proliferativnu i sporogonijsku (slika). Spore su infektivni oblici i obično se dobijaju gutanjem ili udisanjem iz okoline. Klijanje rezultira ekstruzijom polarnog filamenta i inokulacijom sporoplazme u ćeliju domaćina, kao što je gore objašnjeno. Alternativno, sporoplazma se može ekstrudirati ekstracelularno i dobiti pristup ćeliji domaćinu nepoznatim mehanizmima. Spore se također mogu fagocitirati pomoću makrofaga, a ekstruzija polarnog filamenta će omogućiti oranizmu da pobjegne iz fagolizosoma. Paraziti se repliciraju unutar citoplazme ćelije domaćina. Postoje značajne varijacije u mehanizmu replikacije između vrsta, u rasponu od binarne fisije do procesa sličnih ‘šizogoniji’ (ponekad se nazivaju merogonija). Neke mikrosporije se repliciraju unutar citoplazme domaćina, dok se druge nalaze unutar parazitofornih vakuola. Nakon umnožavanja, organizmi se diferenciraju u zrele spore, što je ilustrovano izgledom polarnog filamenta i debelog zida spora. Zrele spore se oslobađaju iz ćelije domaćina i uglavnom se izlučuju izmetom ili urinom. Neke mikrosporije insekata se šire nakon smrti domaćina.
Mikrosporidijske infekcije ljudi
Izvještaji o ljudima zaraženim mikrosporidijom bili su izuzetno rijetki prije epidemije AIDS-a. Mikrosporidija je sada prepoznata kao značajni patogen kod imunokompromitovanog domaćina, a kliničke manifestacije uključuju crijevna, očna, sistemska i mišićna oboljenja. Enterocytozoon bieneusi i tri vrste Encepalitozoon su primarne mikrosporidne vrste povezane s ljudima (tabela). Sporadično je prijavljeno nekoliko drugih vrsta.
| Microsprora otkrivena kod ljudi | ||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
* Postoji i nekoliko izvještaja o Microporidium vrsta koja je sveobuhvatna roda za Microspora koji nisu mogli biti tajna. |
||||||||||||||||||
E. bieneusi je najčešća mikrosporidija koja inficira ljude i glavni je uzrok dijareje povezane sa AIDS-om. Prvenstveno inficira epitelne stanice crijeva i uzrokuje kroničnu dijareju kod pacijenata sa AIDS-om. Diseminacija na druga mjesta nije uobičajena i prvenstveno je ograničena na jetru, žučnu kesu i pluća. Osim toga, E. bieneusi je povezan sa samoograničavajućim proljevom kod imunokompetentnih osoba. E.bieneusi se nalazi kod drugih životinja i svinje su mogući izvor infekcije, ali zoonoza nije dokumentirana. Prijenos sa čovjeka na čovjeka fekalno-oralnim putem je vjerovatno najvažniji način prijenosa.
Tri vrste Encephalitozoon se morfološki ne razlikuju. Oni se repliciraju binarnom fisijom unutar parazitoforne vakuole, za razliku od Entercytozoon-a, koji formira višejezgrene ‘meronte’ u direktnom kontaktu sa citoplazmom domaćina. Ove tri vrste imaju tendenciju da proizvode različite kliničke manifestacije, ali sve mogu inficirati makrofage i izazvati diseminiranu bolest. E. intestinalis, ranije nazvan Septata intestinalis, povezan je s hroničnom dijarejom kod pacijenata sa AIDS-om i rjeđe uzrokuje diseminiranu bolest. E. hellem je povezan s keratokonjunktivitisom i kod imunokompromitiranih i kod imunokompetentnih osoba, ali samo proizvodi diseminiranu bolest u kombinaciji sa supresijom imuniteta. E. cuniculi inficira širok spektar sisara i može zaraziti nekoliko različitih organskih sistema.
Kliničke karakteristike
Najčešća manifestacija mikrosporidioze je dijareja zbog E. bieneusi ili E.
|
Intestinalna mikrosporidioza
Očna mikrosporidioza
Sistemska mikrosporidioza
Dijagnoza
Tretman
|
intestinalis. Pacijenti sa AIDS-om sa brojem CD4+ <200/mm3 posebno su skloni razvoju hronične i iscrpljujuće dijareje koja dovodi do sindroma gubitka (kaheksije). E. bieneusi obično ostaje lokaliziran i inficira enterocite tankog crijeva (jejunum i duodenum). Patologija povezana s infekcijom uključuje: gubitak enterocita, atrofiju vilusa (zatupljivanje), malapsorpciju, hiperplaziju kripte i infiltraciju mononuklearnih stanica. Encephalitozoon vrste u početku inficiraju enterocite u tankom crijevu, uzrokujući oštećenje crijevnih stanica i upalu. Ovi organizmi također mogu inficirati makrofage u lamini propria i diseminirati po cijelom tijelu.
Očnu mikrosporidiozu uzrokuje nekoliko mikrosporidijskih vrsta od kojih je E. hellem najčešća. Imuno kompetentne osobe obično pokazuju keratitis ili čir rožnjače, što je moguće povezano s traumom; dok je kerato-konjunktivitis povezan sa AIDS-om. Sistemska mikrosporidioza se često manifestuje kao popratna infekcija kerato-konjunktiva, urinarnog trakta i bronhija.
Dijagnoza mikrosporidioze zavisi od identifikacije spora u izmetu, urinu, drugim tjelesnim tečnostima ili unutar tkiva. To može biti teško zbog male veličine spora i nepravilnog izlučivanja spora. Modifikovana trihromna boja u kojoj je povećana komponenta hromotropa 2R uobičajena je dijagnostička metoda. Fluorohrom mrlje, kao što su calcofluor white, Uvitex 2B ili Fungifluor, vezuju hitin sa visokim afinitetom i mogu se koristiti kao osjetljiva metoda detekcije. Međutim, potreban je fluorescentni mikroskop. Biopsiju treba uraditi ako se spore ne otkriju u tjelesnim izlučevinama. Pojavit će se problemi sa specifičnostima u pogledu identifikacije vrsta na nivou svjetlosnog mikroskopa. Za konačnu dijagnozu i speciaciju potreban je elektronski mikroskop za detekciju polarnog filamenta. Međutim, elektronska mikroskopija je skupa i dugotrajna, te stoga nije prikladna za rutinsku dijagnozu.
Albendazol, inhibitor mikrotubula, trenutno je najefikasniji lijek za liječenje infekcija mikrosporidijom. Međutim, albendazol ima upitnu efikasnost protiv E. bieneusi. Lokalni fumagilin se preporučuje za liječenje kerato-konjunktivitisa.
Recenzije o mikrosporidiji:
- Didier, ES (1998) Microsporidiosis. Kliničke infektivne bolesti 27:1-8.
- Schottelius, J and Goncalves da Costa SC (2000) Microsporidia and acquired immunodeficiency syndrome. Memoari Instituta Oswaldo Cruz 95:133-139.
LINKOVI
- Vrh
- Oportunističke infekcije
- Pneumocystis carinii Pneumonija (PCP)
- Microsporidija
- Protozoologija Početna stranica
- Ostali kursevi i predavanja
- Wiser Početna stranica
Mark F. Wiser, Univerzitet Tulane (©2000). Poslednje ažuriranje 14. januara 2019 .