Source: http://www.tulane.edu/~wiser/protozoology/notes/malaria.html
Malarija je bio i još uvijek je uzrok mnogo ljudskih morbiditeta i mortaliteta. Iako je bolest je iskorijenjena u većini umereno zonama, to je i dalje endemska
| Istorijski pramenovi | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
tokom mnogo tropima i Subtropics. Četrdeset posto svjetske populacije živi u endemskim područjima. Epidemije su devastirani velike populacije i malarije predstavlja ozbiljnu prepreku za ekonomski napredak u mnogim zemljama u razvoju. Procenjuje se 300-500.000.000 slučajeva kliničke bolesti godišnje sa 1,5-2700000 smrtnih slučajeva. Neki od najranijih poznatih medicinskih spisa iz Kine, Asirije, i Indija precizno opisuju malarije nalik prekidima groznice. Hipokrat, otac medicine “, je uglavnom zaslužan za prvi opis kliničkih simptoma u 500 BC, više od 2000 godina prije nego što je parazit je opisan (tabela). [Vidi također Wikipedia članak o istoriji malarije.]
- Životni ciklus
- Kliničke manifestacije
- Patogeneza i cerebralne malarije
- Epidemiologija i kontrola
- Dijagnoza
- Hemoterapije i otpornost na lijek
Malarija je uzrokovana članovi roda Plasmodium. Plasmodium vrste su apicomplexa (vidi opšti opis apicomplexa) i pokazuju heteroxenous životni ciklus koji uključuje kičmenjaka domaćina i od insekata vektora. Kičmenjaka Domaćini su: gmizavci, ptice, glodari, majmuni i ljudi. Plasmodium vrste su obično domaćin specifične i vektor specifična je po tome će svaka vrsta samo zaraziti ograničen raspon domaćina i vektora. Četiri različite vrste zaraženi ljudi: P. falciparum, P. vivax, P. ovale i P. malariae. (Pogledajte stranicu na razlike vrsta.) Vrste se razlikuju u odnosu na njihovu morfologiju, detalji njihovog životnog ciklusa, a njihove kliničke manifestacije.
Životni ciklus
Ljudskih i drugih vrsta sisavaca Plasmodium se prenose anopheline komaraca. Parazit se ubrizgava sa pljuvačkom tokom komarac hranjenja i prvi prolazi kroz krug merogony u jetri slijedi više rundi merogony u eritrocitima. Gametogony počinje u eritrocita domaćina kičmenjaka i završi unutar komarca, gdje sporogony odvija. Ovaj životni ciklus pokazuje opće karakteristike drugih apicomplexan parazita odlikuje aseksualni replikaciju i formiranje invazivnih faza sa tipičnim apikalni organela.
Faza jetre. Ljudska infekcija se pokreće kada se sporozoites ubrizgava sa pljuvačkom tokom komarac hranjenja. U sporozoites ulaze u krvotok i unutar 30-60 minuta će napasti jetru ćeliju. Host ulazak ćelija, kao iu svim apicomplexa, olakšano je apikalni organela. Nakon invazije hepatocita, parazit prolazi aseksualnih replikacije. Ovaj replikativnu faza se često naziva exoerythrocytic (ili pre-eritrocita) schizogony. Schizogony odnosi na replikativnu proces u kojem parazit prolazi višestruke kruga nuklearnih podjele bez citoplazmatske podjela slijedi u usponu, ili segmentacija, da formiraju potomstvo. Potomstva, pod nazivom merozoites, se oslobađaju u krvotok sljedeće ruptura domaćina hepatocita. (Vidi ciklus figura život.)
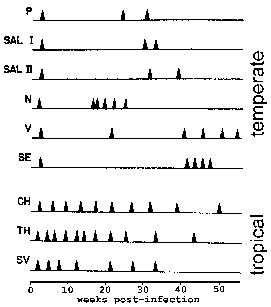
U P. vivax i P. ovale neke sporozoites ne odmah podvrgnuti aseksualni replikacije, ali unesite uspavano fazu poznatu kao hypnozoite. (Međutim, neka pitanja o tome da li P. ovale eksponata fazi hypnozoite su podigli Pogledajte Richter et al, 2010, parazitologiju Research 107:.. 1285) Ova hypnozoite može reaktivirati i proći schizogony kasnije dovelo do relapsa. Relapse ima posebno značenje u odnosu na malarije i odnosi se na reaktivacije infekcije preko hypnozoites. Ponovno izbijanje se koristi da opiše situaciju u kojoj parasitemia padne ispod uočljive nivoa, a kasnije se povećava na patent parasitemia. Zanimljivo, sojevi izolirani iz Sjeverne Amerike područja imaju tendenciju da pokazuju više latentni period između primarne infekcije i prvi relaps od sojeva iz tropskih područja sa Automatska transmisija (Slika).
Faza krvi. Merozoites pušten iz zaraženih ćelija jetre invaziju eritrocita. U merozoites prepoznaju specifične proteine na površini eritrocita i aktivno napadaju ćelije na način sličan drugim apicomplexan parazita. (Vidi detalje o mehanizmu ćelije domaćina invazije.) Nakon ulaska u eritrocita parazita prolazi kroz trofičkim period praćen aseksualni replikacije. Mladi trophozoite se često naziva prsten oblik zbog morfologije u Geimsa-obojena krv razmaza. Kako je parazit raste u veličini ovom ‘prsten’ morfologija nestaje i to se zove trophozoite. Tokom trofičkog periodu parazita unosi citoplazmi ćelije domaćina i razlaže hemoglobina u amino kiseline. A nusproizvod hemoglobina varenje je malarije pigment, ili hemozoin. (Vidi napomene na hranu vakuole plasmodium.) Ove zlatno-smeđe do crne granule su odavno prepoznali kao posebnost krvi-faze parazita.
Nuklearna podjela označava kraj pozornice trophozoite i početak faze schizont. Eritrocita schizogongy se sastoji od 3-5 kruga (u zavisnosti od vrste) nuklearnog replikaciju praćeno Budding proces. Kasnoj fazi schizonts u kojima pojedinac merozoites postati nazire se nazivaju segmenters. Domaćin eritrocita rupture i oslobađa merozoites. Ove merozoites invaziju novih eritrocita i pokrenuti još jedan krug schizogony. Krv-fazi paraziti unutar domaćina obično prolaze kroz sinhroni schizogony. Istovremeni rupture zaraženih eritrocita i istovremeno oslobađanje antigena i otpadnih proizvoda računi za povremena groznica paroksizme povezani s malarijom. Krv fazi schizogony u P. falciparum se razlikuje od drugih ljudskih malarije parazita u toj trophozoite- i schizont inficiranih eritrocitima pridržavaju kapilarnog endotela ćelije i ne nalaze u perifernu cirkulaciju. Ovaj sekvestracija je povezana s cerebralnom malarije. (Vidi ciklus figura život.)
Faza seksualno. Kao alternativa schizogony neke od parazita će proći seksualni ciklus i smrtno se diferenciraju u bilo mikro ili macrogametocytes. Faktori koji su uključeni u indukciji gametocytogenesis nisu poznati. Međutim, posvećenost seksualni fazi javlja tokom aseksualni eritrocita ciklusa koji neposredno prethodi gametocyte formacije. Kći merozoites iz ovog schizont će se razviti u bilo sve aseksualni oblike ili sve seksualne oblike. Gametocytes ne uzrokuju patologiju u ljudskom domaćinu i da će nestati iz opticaja ako ne zauzima komarca.
Gametogeneze, ili stvaranje mikro- i makrogametes, je inducirana kada se gametocytes progutati komarca. Nakon gutanja od strane komaraca, u microgametocyte prolazi kroz tri kruga nuklearnih replikacije. Ovih osam jezgara onda postaju povezani s flagella da izlaze iz tijela microgametocyte. Ovaj proces je lako uočljivi pod svjetlosnim mikroskopom zbog mlaćenje flagella i zove se exflagellation. U macrogametocytes dospijevaju u macrogametes. Međutim, na morfološke nivou to je mnogo manje dramatičan nego exflagellation izloženi od strane microgametocytes.
Exflagellation nastaje spontano kada se zaražene krvi u zraku. Kritični faktori koji su uključeni u indukciji ove gametogeneze su pad temperature, pad u
| Gametogenesis/Exflagellation |
|---|
|
otopljenog ugljičnog dioksida i naknadno povećanje pH iznad 8,0 (Box). To donekle imitira promjene životne sredine doživljava gametocytes u da će biti promjena u temperaturi i creva od komaraca pokazuje pH od oko 7,8 u odnosu na pH od 7,4 za krvi. Osim toga, komarac-izvedeni exflagellation faktor (MEF) je također opisao i identifikovan kao xanthurenic kiselina, metabolit od insekata. Xanthurenic kiselina smanjuje popustljiv pH za exflagellation ispod 8.0 i eventualno biološki znak za parazita da se podvrgnu gametogeneze (Billker et al, Nature 392: 289, 1998, Billker et al, Cell 117: 503, 2004).
Visoko mobilne microgametes će tražiti i spajaju sa macrogamete. U okviru 12-24 sati rezultirajući zigota razvija u jedan ookinete. U ookinete je pokretnih invazivna faza koja će poprečno kako peritrophic matrica i midgut epitela komaraca. Transversing je midgut epitela uključuje invaziju i izlazak iz nekoliko epitelnih stanica prije pojavljuju na bazalni strani epitela. Proces invazija je sličan drugim apicomplexa osim što ookinete nema rhoptries i ne formira parasitophorous vakuole nakon invazije na ćelije domaćina. (Vidi detalje o mehanizmu ćelije domaćina invazije.)
Sporogony. Nakon dostizanja ekstracelularnog prostora između epitelnih stanica i bazalnih lamina, na ookinete razvija u jedan oocyst. U oocisti proći kroz aseksualni replikaciju, pod nazivom sporogony, koji kulminira u proizvodnji nekoliko hiljada sporozoites. To obično traje 10-28 dana, ovisno o vrsti i temperaturi. Nakon sazrijevanja su oocyst ruptura i oslobađa sporozoites koji prelaze bazalne lamine u hemocoel (tijelo šupljine) od komaraca. (Vidi ciklus figura život.)
Ove sporozoites su pokretljive i imaju sposobnost da se posebno prepoznaju žlijezda slinovnica. Nakon pronalaska žlijezda slinovnica u sporozoites će napasti i poprečne pljuvačnih žlijezda epitelne ćelije i doći do leže u okviru svojih lumena. Neke od ovih sporozoites će biti protjeran u domaćina kičmenjaka kao komarac uzima obrok krvi, a time i ponovo započnu infekcije u domaćina kičmenjaka. Iako hemocoel i pljuvačnih sporozoites žlijezda su morfološki slične, oni su funkcionalno razlikuju. Pljuvačnih žlijezda sporozoites efikasno invaziju ćelija jetre, ali ne mogu ponovo napadnu žlijezda slinovnica, a hemocoel sporozoites su neefikasni u invaziju ćelija jetre.
Ukratko, malarije pokazuje životni ciklus s tipičnim apicomplexan karakteristikama. Postoje tri različita invazivne faze: sporozoite, merozoite i ookinete. Sve se odlikuju apikalnog organele i mogu napasti ili proći kroz domaćina ćelije. se uočavaju dva različita tipa merogony. Prva, pod nazivom exoerythrocytic schizogony, javlja u jetri i pokreće se sporozoite. Dobijena merozoites onda napasti eritrocita i prolaze kroz ponovljene rundi merogony zove eritrocita schizogony. Neki od merozoites proizvedeno od eritrocita schizogony će proći gamogony. Plasmodium gamogony je opisan u dvije faze: gametocytogenesis koje se pojavljuju u krvotok domaćina kičmenjaka, i odvija gametogeneze u komaraca Gut. U gameta osigurač da postane zigota koja prvi razvija u jedan ookinete a zatim postaje oocyst gdje sporogony odvija.
(Za pregled životnog ciklusa unutar komarca vidjeti LA Baton, LC Ranford-Cartwright (2005) Širenje sjeme miliona ubistvo smrt:. Metamorfoze malarije u komaraca Trendovi u parazitologiju 21, 573-580.
Kliničke manifestacije
U patologije i kliničke manifestacije povezane sa malarijom su gotovo isključivo zbog aseksualni eritrocita fazi parazita. Tkiva schizonts i gametocytes izazvati malo, ako ih ima, patologije. Plasmodium infekcija uzrokuje akutna febrilna bolest koja je najviše poznat po svojim periodičnim groznice paroksizme koje se pojavljuju na bilo 48 ili 72 sata intervalima. Ozbiljnost napada ovisi o vrstama Plasmodium, kao i druge okolnosti, kao što je stanje imuniteta i opće zdravlje i nutritivni status zaraženog pojedinca. Malarija je hronična bolest koja ima tendenciju da relaps ili opet izbiti (vidi objašnjenje razlike) više mjeseci ili čak godina.
Najčešći način da se dobije malariju je kroz prirodni prijenos komarci (vidi životni ciklus). Malarija se može prenositi preko transfuzije krvi ili dijeljenje šprica. Mehanički prijenos zaražene krvi će rezultirati u kraćem periodu inkubacije jer neće biti ni u jednom trenutku jetra. Tu je i povećan rizik od smrtnosti kod mehanički prenose P. falciparum. Nedostatak faze jetre infekcije također isključuje recidiva u P. vivax ili P. ovale infekcija. Kongenitalna prijenos je i dokumentovano, ali se vjeruje da je relativno rijetke uprkos jakoj infekcije posteljice.
| Exoerythrocytic schizogony i prepatent i inkubacije razdoblja | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
Simptomi malarije obično počinju da se pojavljuju 10-15 dana nakon ugriza zaraženog komarca. Tipičan prepatent i inkubacije razdoblja sljedeće sporozoite inokulacije varirati u zavisnosti od vrste (tabela). U prepatent razdoblje se definira kao vrijeme između sporozoite inokulacije i izgled parazita u krvi i predstavlja trajanje faze jetre i broj merozoites proizvedenih. Inkubacija razdoblja imaju tendenciju da budu malo duže i definira se kao vrijeme između sporozoite inokulacije i pojave simptoma. Ponekad inkubacije razdoblja može se produžiti za nekoliko mjeseci u P. vivax, P. ovale, i P. malariae. Sva četiri vrste mogu izlagati nespecifični prodromalnih simptoma nekoliko dana prije prvog febrilan napad. Ovi prodromalnih simptomi se obično opisuju kao ‘gripu’ i uključuju: glavobolja, blaga groznica, bol u mišićima, anoreksija, mučnina i malaksalost. Simptomi obično u korelaciji sa povećanjem broja parazita.
Ovi prodromalnih simptomi će biti praćen febrilna napada također poznat kao malarije paroksizme. Ove paroksizmi će izložiti periodičnosti od 48 sati za P. vivax, P. ovale, i P. falciparum, i 72-satni periodičnost za P. malariae. U početku periodičnost ovih paroxyms može biti nepravilan kao legla u merozoites iz različitih exoerythrocytic schizonts sinhronizaciju. To se posebno odnosi na P. falciparum koji ne mogu imati različita paroksizme, ali pokazuju kontinuirani groznica, svakodnevno napadi ili nepravilne napada (npr., 36-48 sata periodičnost). Pacijenti mogu također pokazati splenomegalija, hepatomegalija (blago žutica), i hemolitičke anemije u periodu u kojem se javljaju na malariju paroksizme.
Malarijskim paroksizma (vidi tabelu) će obično traju 4-8 sati i počinje nagli početak jeza u kojima pacijent doživljava intenzivan osjećaj hladnoće uprkos tome što je povišene temperature. Ovo se često naziva hladne faze i odlikuje snažan drhtanje. Odmah nakon ove hladne fazi je vruća faza. Pacijent osjeća intenzivan topline u pratnji jake glavobolje. Umor, vrtoglavica, anoreksija, mialgija, a mučnina često će biti povezan s vrućim sceni. Sljedeći period obilno znojenje će nastupiti i groznica će početi da opada. Pacijent je iscrpljena i slaba i da će obično zaspati. Nakon buđenja pacijent obično oseća dobro, osim umora, i ne pokazuju simptome sve do početka naredne paroksizma.
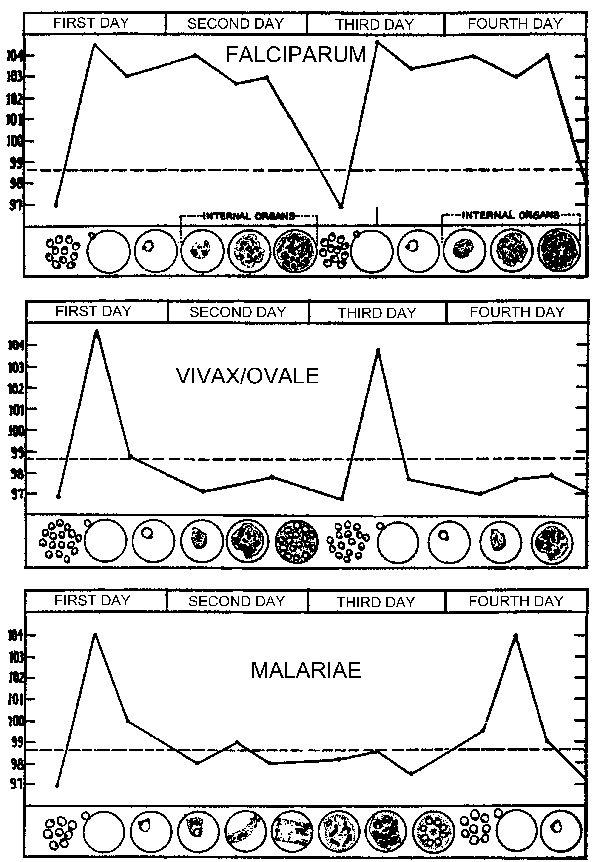
Periodičnost ovih paroksizme je zbog sinhronog razvoj malarije parazita unutar ljudskog domaćina. Drugim riječima, sve parazita unutar domaćina su na približno istoj fazi (tj, prsten, trophozoite, schizont) jer su nastavili kroz schizogony. Malarijskim paroksizma odgovara rupture zaraženih eritrocita i oslobađanje merozoites (slika gore). U 72 sat periodičnost u P. malariae je zbog svog sporijeg rasta i sazrijevanje u krvi-fazi schizogony. Studije u P. vivax su pokazali povezanost između groznice i seruma TNF-α (faktor tumorske nekroze-alfa) razine (slika desno). Pretpostavlja se antigeni ili toksini se oslobađaju kada zaražene eritrocita ruptura i dovesti na proizvodnju TNF-α i febrilnih napada.
Ozbiljnost paroksizme i trajanje simptoma varira ovisno o vrsti (vidi tabelu ispod). U principu, težine bolesti u korelaciji s prosječnom i maksimalnom parasitemia izloženi od strane raznih vrsta. P. falciparum je sposobna da proizvede teške i smrtonosne infekcije, dok su druge vrste su rijetko smrtni. Pacijenti zaraženi P. vivax, posebno za prvi put, može biti prilično bolestan. Međutim, P. vivax rijetko uzrokuje komplikacije ili rezultate u smrt. Na povodom teške malarije uključuju više organa je i navedeno u P. vivax infekcije (vidi Kochar et al, EID 11 (1), januar 2005.). Recidiva do aktiviranja P. vivax hypnozoites može doći za nekoliko godina. P. ovale je najviše benigna u da paroksizme imaju tendenciju da budu blage i kratkog trajanja i recidiva rijetko javljaju više od godinu dana nakon početne infekcije. P. malariae uglavnom proizvodi blage bolesti, ali početne paroksizme može biti umjeren do teških. To je najviše hronični, međutim, i recrudescences su dokumentirani nekoliko decenija nakon početne infekcije. Ovaj hroničnosti je ponekad povezan sa bubrežnim komplikacijama, koje su vjerovatno zbog taloženja antigen-antitijelo kompleksa u glomerula bubrega. Malarijskim paroksizmi će postati manje ozbiljne i nepravilnog periodičnost kao domaćin razvija imunitet. Ovaj imunitet, međutim, nije sterilizaciju imunitet u da se infekcija i dalje postoji duže od simptoma i pojedinci mogu pokazati recidiva ili recrudescences ili postati reinfected. Ako ne leči, svih oblika malarije imaju tendenciju da budu hronični.
| Bolest težinu i trajanje | |||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
|||||||||||||||||||||||||||||||||||||||||||||
| Povećana morbiditeta i mortaliteta od falciparum malarije |
|---|
|
Za razliku od ostale tri vrste, P. falciparum može proizvesti ozbiljne bolesti s posmrtnim posljedicama. Ova povećana morbiditeta i mortaliteta je dijelom zbog visoke parasitemias povezane sa P. falciparum infekcija. Ovi potencijalno visoke parasitemias su dijelom zbog velikog broja merozoites proizvedenih i sposobnost P. falciparum da napadne sve eritrocite. Nasuprot tome, P. vivax i P. ovale vole retikulocita (i.e., nezrelih eritrocita), dok je P. malariae preferira starosni eritrocita (vidi razlike vrsta). U parasitemia može brzo povećati zbog cytoadherence i sekvestracija P. falciparum. Ovo sekvestracija u tkivima smanjuje uklanjanje zaraženih eritrocita slezine i omogućava efikasnije eritrocita invaziju .. Visok parasitemia i rezultat sekvestracija u druge komplikacije povezane sa falciparum malarije, najviše biće anemija i cerebralne malarije (raspravlja u sljedećem odjeljku ). U anemija je djelomično zbog uništavanja eritrocita u krvi-fazi schizogony. Osim toga, ne-zaraženih eritrociti su uništeni na višim stopama tokom infekcije, a postoji i smanjene proizvodnje eritrocita.
Patogeneza i teške malarije
Patologija povezana sa svim malarije vrsta odnosi se na rupturu zaraženih eritrocita i oslobađanje parazita materijala i metabolite, hemozoin (tj, malarija pigmenta) i mobilne ostatke. Pored paroksizme gore navedeno, taloženje hemozoin je odavno poznat kao karakteristična malarije. Postoji povećana aktivnost reticuloendotelijalnom sistema, posebno u jetri i slezeni i na taj način njihovo proširenje, o čemu svjedoče makrofagi sa proguta zaraženim i normalno eritrocita i hemozoin. Osim P. falciparum, patologija povezana sa malarijom ima tendenciju da bude benigni. Nekoliko teških komplikacija može biti povezana sa falciparum malarije s cerebralnom malarije što je najznačajniji i čest uzrok smrti.
Cerebralne malarije odlikuje se oštećenom svesti (Box). Simptomi predstavljanja su jaka glavobolja praćena pospanost, zbunjenost, i na kraju koma. Grčevi su također često povezani s cerebralnom malarije. Ove neurološke manifestacije Vjeruje se da su zbog zaplene zaraženog eritrocita u cerebralnom mikrovaskularizacije. Sekvestracija odnosi na cytoadherence od trophozoite- i schizont inficiranih eritrocita za endotelne ćelije duboko vaskularnih kreveta u vitalnih organa, posebno mozak, pluća, crijeva, srce i placente. Ovaj sekvestracija pruža nekoliko prednosti za parazita. Glavna prednost je izbjegavanje slezine i kasnije eliminacija zaraženi eritrocita. Osim toga, niske napetosti kisika u dubokim tkivima može dati bolji metabolički okruženju.
Cytoadherence Čini se da posreduje elektron-guste izbočine na površini zaraženih eritrocita. Ovi ‘kvake’ su izraženi u trophozoite i schizont faze i nastaju kao
| Cerebralne malarije |
|---|
|
rezultat parazita proteina izvozi na membrane eritrocita. Među vrstama ljudskih Plasmodium, kvake su ograničena na P. falciparum i na taj način pokazuju da dugmad igraju ulogu u cytoadherence. Osim toga, tu je i dobra korelacija između životinjskih Plasmodium vrsta koje izražavaju gumbi i izložba sekvestracija. Elektronska mikroskopija pokazuje da su dugmad su kontakt između zaraženi eritrocita i endotelnih ćelija.
| PfEMP-1 |
|---|
|
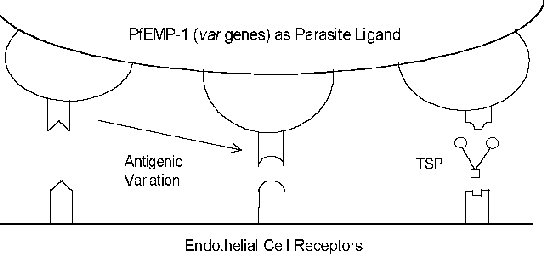
Molekularni mehanizmi cytoadherence uključuju receptor-ligand interakcije. Drugim riječima, proteini izrazio na površini zaraženih eritrocita (ligand) će se vezuju za proteine izražene na površini endotelnih ćelija (receptora). PfEMP-1 (eritrocita membrane protein) je parazit protein koji je upleten kao cytoadherence ligand (Box). U constrast na obično veoma očuvana priroda receptora-ligand interakcije, PfEMP-1 je član visoko varijable (= var) gena porodice sa 40-50 različitih gena. Nekoliko domaćin proteine koji eventualno funkcionirati kao receptori su identificirani (vidi okvir ispod). Mnoge od ovih domaćina proteina funkcionirati u ćeliji ćelija interakcije i uključeni su u ćelijskom prianjanje. Nekoliko studija ukazuju na to da je izraz različitih PfEMP-1 gena je u korelaciji s različitim fenotipova receptora vezivanja. Ovo
antigeni varijacija povezanih s površinom izložene PfEMP-1 omogućuje parazit da izbjegne imunološki sistem. Međutim, funkcija cytoadherence je očuvana kroz svoju sposobnost da prepoznaju više receptora (Slika). Ovo antigeni varijacija može objasniti različite ishode bolesti. Na primjer, međućelijski prianjanje molekula-1 (ICAM-1) obično je umiješan u cerebralnom patologije.
| Moguće Receptori |
|---|
|
Kliknite ovdje za više informacija o dugmad, receptore / ligandi, i antigena varijacija.
Rano zapažanja patologije cerebralne malarije predložio vezu između velikog broja zaraženih eritrocita u mikrovaskularizacije i razvoj sindroma. U početku se pretpostavljalo da će cytoadherence dovesti do mehaničkom blokadom (i.e., cerebralne ishemije), a zatim hipoksije. Osim toga, parazit takođe može uzrokovati lokalizirane metaboličke efekte kao što su hipoglikemija i / ili mliječne acidoze. Efekti hipoksija i metaboličkih bi onda izazvati komu i naknadne smrti.
Međutim, postoje neki problemi sa zaplene hipoteze:
Neurološki posledice među preživjele cerebralne malarije:
van Hansbroek (1997) J. Ped. 131:125 |
- koma povezane s cerebralnom malarije je brzo reverzibilni nakon tretmana,
- visok postotak preživjelih nemaju permanant neuroloških komplikacija,
- nedostatak ishemijskog oštećenja (isključuje hipoksija kao glavni mehanizam),
- sekvestracija također javlja u ne-cerebralne malarije.
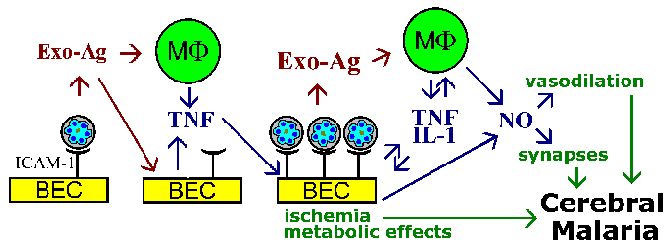
Zbog ovih problema drugi su predložili da se komu je posredovana kratkog daha molekule koje utječu na moždane funkcije. Moguće domaćin posrednika uključuju citokine, kao što je TNF-a, ili azot oksida. U ovoj teoriji citokina, malarije antigena bi stimulirati TNF-a koji bi se onda izazvati azot oksida ili imaju druge patološke efekte. Azot oksid se zna da utiču neurona funkciju i to može dovesti i do intrakranijalne hipertenzije kroz vazodilatator aktivnost. Malo je vjerovatno, međutim, da je sistemski oslobađanje citokini bi izazvati komu i potrebno je da se pretpostaviti da oslobađanje od tih medijatora u mozgu će dovesti do visoke lokalne koncentracije. Osim toga, postoji minimalna limfocita infiltracija ili upale povezane s blokiranim kapilare.
U sekvestracija hipoteza i teorija citokina za patofiziologiju cerebralne malarije se međusobno ne isključuju, a oba fenomen vjerovatno će biti uključeni. Na primjer, parazit Exo-antigena, koji su pušteni na eritrocita rupture, poznato je da stimulišu makrofage da luči TNF-a. TNF-a je poznat Regulira izraz adhezije molekula, kao što su ICAM-1 na površini mozga endotelnih ćelija. To bi dovelo do povećanja vezivanje zaraženih eritrocita i pojačati efekte da li su zbog vaskularne blokade, topljivih posrednika, metabolički efekti, ili kombinacija (Slika).
Ukratko:
- P. falciparum može izazvati teške i fatalne bolesti
- ovo povećala pathogenecity u odnosu na druga ljudska malarije se odnosi na P. falciparum-a:
- visoke reproduktivnu sposobnost
- cytoadherence i sekvestracija
- sekvestracija doprinosi veći reproduktivni kapacitet preko izbjegavanje slezene
- je cytoadherence da endotelne ćelije mogao imati lokalne patološke efekte, a posebno je vjerovatno uključen u cerebralne malarije
- patofiziologije cerebralne malarije nije u potpunosti razumio, ali vjerojatno uključuje više faktora i kompleksne interakcije između domaćina i parazita
Komentari na teške malarije i patogeneza:
- IA Clark, WB Cowden (2003) Patofiziologija falciparum malarije. Farmakologija i terapija 99, 221-260.
- R Idro, NE Jenkins, CRJC Newton (2005) Patogeneza, klinička slika, i neurološki ishod cerebralne malarije. The Lancet Neurology 4, 827-840.
- CL Mackintosh, JG Beeson, K Marsh (2004) Kliničke karakteristike i patogeneza teške malarije. Trendovi u parazitologiju 20, 597-603.
- A Trampuz, M Jereb, ja Muzlovic, RM Prabhu (2003) Klinički pregled: Teška malarija. Critical Care 7, 315-323.
Epidemiologija
| Idi na odjeljak na: |
Malarija je prvenstveno bolest tropima i Subtropics i raširena u vrućim vlažnim područjima Afrike, Azije i Južne i Centralne Amerike. Bolest je također uobičajena u mnogim umereno područjima, uključujući i SAD, Evropi i sjevernoj Euroazija i Aziji, ali je iskorijenjena. U mnogim područjima koja su ranije imali malariju pod kontrolom se doživljava preporod (vidi članak u The Atlantic). Četiri ljudske malarije vrste pokazuju preklapanje geografske distribucije (tabela). P. vivax i P. falciparum su najčešće susreću vrsta sa P. vivax što je najrasprostranjenija geografski. Mješoviti infekcije su uobičajene u endemskim područjima. Molekularne metode ukazuju na to da P. malariae i P. ovale može biti više rasprostranjen i prevladava da se ranije mislilo (vidi Mueller i dr, Tr Parasitol 23:.. 278, 2007).
Geografski distribucije |
||||||||
|---|---|---|---|---|---|---|---|---|
|
| Epidemiologija malarije |
|---|
stabilne ili endemske malarije
nestabilna ili epidemije malarije
|
Epidemiologiju malarije možete pogledati u smislu da su stabilne (ili endemske) ili nestabilne (ili epidemije). Stabilno malarije se odnosi na situaciju u kojoj se nalazi mjerljiv učestalost prirodnih prenosa preko nekoliko godina. To bi također uključivati područja koja doživljavaju sezonski prijenos. Različitim područjima može iskusiti različite nivoe stope incidencije i to se često označava kao: hypoendemic, mesoendemic, hiperendemičnom, i holoendemic. Osobe koje žive u visoko endemskim područjima obično pokazuju visok nivo imuniteta i dobro podnose infekcije.
Nestabilno, ili epidemije, malarije se odnosi na povećanje malarije u područjima niskog endemičnosti ili epidemija u područjima prethodno bez malarije ili među ne-imuni osobe. Ove pojave se obično mogu pripisati promjenama u ljudskom ponašanju ili uticaja na životnu sredinu. Na primjer, ljudski migracije i preseljenja mogu ili uvesti malarije u područje ili izlagati prethodno nisu imuni stanovništva endemske prijenos. Promjene u ekologiji uzrokovane prirodnim katastrofama ili projekte javnih radova kao što su izgradnja puteva može utjecati i malarije prijenos i dovesti do epidemije.
“Sve u vezi malarije je tako oblikovani od strane lokalnih uslova da postane hiljadu epidemiološke zagonetki.”
Hackett (1937)
Navedeni citat naglašava složenost malarije i mnoge aspekte eksponate bolesti. Različitih zajednica će doživjeti drugačiji malarije i samim tim različite kontrolu i tretman strategija može biti potrebno. U zamršene interakcije između domaćina, parazita i vektora su glavni faktori u ovom epidemiološkim složenosti.
Na primjer, kao i kod svih vektora prenosive bolesti, parazit mora biti u stanju da se uspostavi hronične infekcije unutar domaćina kako bi se povećala šanse za prijenos. To se posebno odnosi na slučaj sezonskih prenosa i u područjima niskog endemičnosti. I općenito malarije infekcije karakteriše početne akutnoj fazi slijedi duži relativno bez simptoma hronične faze. To je dijelom zbog sposobnosti parazita da se izbegne kompletan izbija imuni sistem. Na primjer, P. falciparum izlaže antigeni varijantu koja omogućava da ostanu korak ispred imunog sistema. Osim toga, P. vivax i P. ovale pokazuju fazi hypnozoite i sposobni recidiva. To omogućava parazita za održavanje infekcije u ljudskom domaćina i nakon što se očisti fazi krv infekcije. Relativna dug interval između relapsa u nekim P. vivax izolira vjerojatno objašnjava svoju sposobnost održavanja prijenos ciklusa u nekim umjerenim klimama.
Nekoliko molekularne studije epidemiologije su pokazale da P. falciparum može proizvesti dugoročne hroničnih infekcija (vidi Roper et al ispod).
Roper et al (1996) AJTMH 54: 325
|
|
||||||||||||||||||||||||
Što se tiče domaćina, ljudi su jedini značajni rezervoar za parazita i zadobio prenosa zavisi održavanje bazena zaraženih pojedinaca i kontakt između ljudi i anopheline komaraca. Nekoliko faktora utiču na osjetljivost ljudi na infekciju. Očigledno je da je imunološki status pojedinca i njihovo prethodno iskustvo s malarijom će uticati na tok infekcije. Trudnice, posebno tokom prve trudnoće, su više podložni falciparum malarije kao što je prikazano od strane višeg prevalencija infekcije i veća parasitemias. Osim toga, neke genetske bolesti i polimorfizama su povezani sa smanjenjem infekcije ili bolesti (vidi Innate otpora).
Potencijal komaraca da služi kao vektor ovisi o sposobnosti da podrži sporogony, komarac obilje, i kontakt s ljudima, koji su svi pod utjecajem klimatskih i ekoloških faktora (tabela). Sposobnost da se podrži sporogony je u velikoj mjeri zavisi od vrste u da nisu sve vrste Anopheles su podložni Plasmodium infekcije. Temperatura i komaraca dugovječnost su drugi ključni faktori koji utiču interakcije parazita sa vektora. Razvoj P. falciparum zahtijeva minimalna temperatura od 20 ° C, dok je minimalna temperatura za druge vrste je 16o Č. Temperatura utiče i na vrijeme razvoja u tom trajanje sporogony je znatno kraće na višim temperaturama. A kraće trajanje sporogony povećava šanse da će komarci prenositi infekciju u okviru svojih životni vijek.
Faktori koji utiču na vektorskih Kapacitet |
||||||
|---|---|---|---|---|---|---|
|
Gustina komaraca i navike hranjenja također utječu na prijenos malarije. gustoća komaraca zavisi od temperature, nadmorske visine, padavina i dostupnost uzgoja mjesta, dok će se ljudski komaraca kontakt uticajem ponašanje komaraca. Na primjer, stepen u kojem određeni vrsta komaraca je anthropophilic će utjecati na vjerojatnost komaraca postanu zaraženi, a zatim prenose infekciju na drugo ljudsko. Ove anthropophilic tendencije su nužno apsolutna u da mnogi zoophilic komarci će se prebaciti na ljude ako gustoće dostići visok nivo ili preferirani izvor životinja se smanjuje. Preferirani vrijeme hranjenja i da li je komarac hrani pretežno u zatvorenom prostoru ili na otvorenom će utjecati na dinamiku prenosa. Na primjer, vanjski hranjenje komarci imaju veće šanse da nađu obrok ljudske krvi u ranim večernjim satima od onih hranjenje kasno noću kada je većina ljudi su unutra. Ponašanje komaraca također treba uzeti u obzir u kontroli aktivnosti.
Imunitet
| “Paradoksalno, rizik od teške bolesti u djetinjstvu bili su najniži među populacijama sa najvišim prijenos intenziteta, a zabilježene su između populacija izložena niskim do umjerenim intenziteta prijenosa najveći rizik od bolesti. ” Snijeg i drugi (1997) Lancet 349 1650 |
Osobe koje žive u endemskim područjima učiniti razviti imunitet protiv malarije. Gotovo uvijek osoba će izlagati simptome tijekom njihovog početnog izloženosti malarije. Simptomi povezani s kasnijim izloženosti malarije su obično blaže, iako. Imunitet protiv malarije sporo razvija i zahtijeva više izloženosti. U visoko endemskim područjima samo mala djeca su na visokim rizikom od razvoja teške falciparum malarije dok starija djeca i odrasli su u suštini zaštićeni od teške bolesti i smrti. Međutim, ovo imunitet nije sterilizaciju imunitet u da osobe i dalje mogu postati zaraženi. Osim toga imunitet je kratkog daha i u odsustvu višekratna izloženost razinu imuniteta smanjuje. Na primjer, prethodno polu-imuni odrasli često će razviti teške malarije po povratku u endemska područja nakon što je u ne-endemskih područja za 1-2 godina. Ovo stanje parcijalnih imuniteta u kojem parasitemia se smanjuje, ali ne i ispao, a parasitemia bolje toleriše (slika) se ponekad naziva premunition. Premunition odnosi se na imunitet koji je kontingent na prisustva patogena.
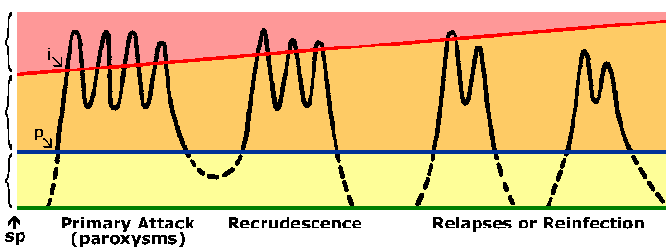
Imuni odgovor može biti usmjerena na bilo pre-eritrocita ili eritrocita fazama životnog ciklusa parazita. Međutim, eritrocita fazi životnog ciklusa je vjerojatno najvažniji u smislu čišćenja parazita i smanjuje bolesti. Zbog nedostatka HLA molekula na površini od parazita ili eritrocita je obično pretpostavlja da će antitijela igrati ključnu ulogu u krvi-fazi imunitet. Mogući mehanizmi effecter za antitijela uključuju: blokiranje eritrocita invazija merozoites, antitijela-zavisne ćelijski ubijanje posredovana cytophilic antitijela, ili povećan klirens zaraženih eritrocita zbog vezivanja antitijela na parazitu antigene izložene na površini eritrocita. Sve ove će rezultirati nižim parasitemia. Relativna važnost ovih različitih mehanizama nije jasan i vjerojatno imunitet vjerojatno zahtijeva stvaranje antitijela protiv brojnih ciljeva. To, zajedno sa antigeni varijacije i polimorfizama u mnogim Plasmodium antigene, mogao objasniti spor razvoj imuniteta.
Zapažanje da asimptomatski pojedinci mogu pokazuju visok nivo parasitemia je dovelo do koncepta ‘imunitet protiv bolesti’. To bi bilo kao dodatak ‘anti-parazit’ imunitet je već rečeno što rezultira nižim parasitemias. Teška malarije i smrt su u korelaciji s TNF-α i drugih proinflamatornih citokina. Kao što je rečeno za paraxoysms i cerebralne malarije, antigena ili toksini koje je objavio zaraženi eritrocita mogao stimulirati proizvodnju proinflamatornih citokina. Antitijela protiv ovih egzibiciji-antigena bi mogao neutralizirati njihove toksične efekte i na taj način dovesti do imunitet protiv bolesti.
Komentar o imunitetu na malarije:
J Langhorne, FM Ndungu, AM Sponaas, K Marsh (2008) imunitet na malariju: više pitanja nego odgovora. Nature Immunology 9, 725-732.
Zbog poteškoća u kontroli malarije na drugi način postoji mnogo interes u razvoju vakcine protiv malarije. Trenutno nema dostupnih vakcina, ali postoji značajan istraživački napor usmjeren na identifikaciju vakcina kandidata i testiranje potencijalnih vakcina za sigurnost i efikasnost. Kompleks životni ciklus i biologija parazita pružaju nekoliko potencijalnih meta (tabela 15.9). Na primjer, vakcinacija protiv sporozoite ili exoerythrocytic fazi mogao spriječiti infekciju. Međutim, imunitet inducirana bi trebala biti u potpunosti na snazi od bijega jednog sporozoite bi dovesti do krvi fazi infekcije i bolesti. Vakcine usmjerena protiv merozoites ili zaraženi eritrocita bi smanjiti parasitemia strane ometa merozoite invazija ili povećanje eliminaciju zaraženih eritrocita. Takva vakcina potencijalno može ublažiti mnogo patogenezi povezane sa malarijom, čak i ako to nije završi efikasan. Osim toga, infekcija može poslužiti za jačanje imuni odgovor. Moguće da se vakcinišu protiv bolesti zaštićenoj protiv potencijalno toksičnih antigena. Antitijela neutrališe antigene koji stimulišu proinflamatorni imuni odgovor može smanjiti neke od patogeneze povezanih s malarijom. Seksualno faze parazita kao što su gametocytes i polnih ćelija mogla biti na meti. Antitijela usmjerena protiv gameta antigena može spriječiti infekciju komaraca i sporogony. Takva vakcina bi altruistička u da neće zaštititi pojedinca od bolesti, ali štite druge u zajednici spuštanjem prijenos.
| Potencijalni Strategije Vaccine | ||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
Ljudske genetike i urođeni otpor
| urođeni otpor |
|---|
|
Određene genetske bolesti i polimorfizama su povezani sa smanjenjem infekcije ili bolesti (Box). Na primjer, pojedinci koji nemaju Duffy krvi-grupa antigena su vatrostalnih P. vivax. Veliki dio stanovništva u zapadnoj Africi su Duffy negativne, tako čini nizak nivo P. vivax u zapadnoj Africi. Ovaj urođeni otpor dovelo do identifikacije Duffy antigena kao eritrocita receptora za merozoite invazije. (Vidi interakcije receptor-ligand tokom merozoite invazije.)
Nekoliko naslijedila poremećaja eritrocita se nalaze uglavnom u malarije endemskim područjima i na frekvencijama mnogo veći nego što se očekivalo. To je dovelo do špekulacija da ovih poremećaja daju neku zaštitu protiv malarije. Na primjer, jugoistočne Azije ovalcytosis je zbog mutacija u membrane eritrocita protein bend 3. Ova mutacija uzrokuje eritrocita membrana postane čvršća i više vatrostalnih da merozoite invazije. Mehanizam (e) kojim se druge bolesti može razgovarati zaštitu protiv malarije nisu poznati. U većini slučajeva se pretpostavlja ili nagađali da kombinacija kvara i infekcija dovodi do preranog lizu ili čišćenje inficiranih eritrocita. Na primjer, glukoza-6-fosfat dehidrogenaze (G6PD) deficitarnih eritrocita bi imao poremećaj sposobnost da upravljaju oksidativnog stresa (vidi Drug Akcija). Dodatni oksidansi nastaje kao rezultat parazita metabolizam i probavu hemoglobina (vidi biokemiju Bilješke) može zatrpati zaraženih eritrocita i dovesti do njenog uništenja prije parazit je u stanju da završi schizogony. Srpastih anemija ćelije i talasemija su takođe spekulisalo da bi zaraženi eritrocita više osjetljiv na oksidativni stres.
Komentari na crvenih krvnih zrnaca polimorfizama i malarije:
- G Min-Oo, P Gros (2005) eritrocita varijante i priroda njihovog malarije zaštitni učinak. Cellular mikrobiologiju 7, 753-763.
- TN Williams (2006) Ljudska crvenih krvnih zrnaca polimorfizama i malarije. Trenutno Mišljenje u mikrobiologiju 9, 388-394.
- TN Williams (2006) ćelija nedostataka Red krvi i malarije. Molekularna i biohemijske parazitologiju 149, 121-127.
Malarija u SD
| Faktori što je dovelo do pada u prijenos malarije u SD. |
|---|
|
Malarija je prethodno više rasprostranjena u umjerenim područjima, uključujući Sjevernoj Americi i Europi. Vjeruje se da je malarija je uvedena u Ameriku od strane Evropske kolonisti (P. vivax i P. malariae) i afričkih robova (P. falciparum) tokom 16. i 17. stoljeća. Malarija je postala endemska u mnogim dijelovima Sjedinjenih Američkih Država bez pustinje i planinskih područja i učestalost vjerojatno vrhunac oko 1875. A pomak stanovništva iz ruralnih u urbana područja, odvodnju močvara za stvaranje poljoprivrednog zemljišta, poboljšanje stanovanja i ishrane, bolje društveno-ekonomske uvjete i standarde život, bolji pristup zdravstvenim uslugama, i dostupnost kinina za tretman doprinijeli padu u rasprostranjenosti malarije i prije uvođenja posebnih mjera kontrole (Box). Neke kontrolne aktivnosti, kao što su detekcija slučaj i liječenje, larviciding i kuća prskanje, uvedene su tokom 1940-ih i dovelo do iskorjenjivanja malarije u Sjedinjenim Američkim Državama. Od 1950-tih su uvezena gotovo svim slučajevima malarije u U.S.. Glavni faktori koji doprinose ovom iskorjenjivanje čini se da je pomak stanovništva iz ruralnih u urbana područja i povećanje životnog standarda, što je rezultiralo poboljšanim stanovanja, bolju ishranu, i bolji pristup zdravstvenim uslugama.
Velika većina malarije slučajeva dijagnosticira u Sjedinjenim Državama stiču osobe, dok putuju u zemlje u kojima je endemska malarija. Međutim, tijekom 1990-ih godina bilo je nekoliko epidemija autohtonih prijenos malarije u Sjedinjenih Američkih Država (Zucker, 1996). Ove pojave su povezani sa gusto naseljenim područjima i veliki broj imigranata. Više od 80% slučajeva su bili P. vivax. Osim toga, epidemija su povezani sa neuobičajeno toplo i vlažno vremena, što može povećati anopheline preživljavanje i smanjiti trajanje sporogonic ciklusa, čime se omogućava razvoj infektivnog sporozoites. (Vidi također nedavnom izvještaju o sedam slučajeva lokalno stečenih P. vivax malarije koja se dogodila na Floridi tokom jula-avgusta 2003, MMWR 52:. 908)
Prevencija i kontrola
smanjiti ljudski komaraca kontakt
smanjiti vektor gustoće
smanjiti parazit rezervoar
|
Strategije za prevenciju i kontrolu malarije uključuju tri različita pristupa (vidi okvir). Prevencija malarije kod osoba će uglavnom uključivati smanjenje ljudskih komaraca kontakt kroz korištenje bednets, repelenti, itd Hemioprofilaksa (vidi dolje) se može koristiti, pogotovo u putnika. Međutim Hemioprofilaksa samo potiskuje parasitemia i ne sprečava infekcije.
Kontrolne aktivnosti na nivou zajednice mogu koristiti pristupa koji direktno smanjuju ljudske komaraca kontakt, kao i pristupe koji smanjuju ukupan broj komaraca na području. Takvi pristupi uključuju smanjenje komaraca plodno tlo (npr okoliša modifikacija), ciljati faze larva hemijskim ili biološkim agensima, i masivnim insekticid prskanje za odrasle komaraca. Biološke metode kontrole uključuju uvođenje ribe koje jedu larve komaraca ili bakterija (npr Bacillus thuringiensis) koje izlučuju larve toksina. otkrivanje i liječenje slučaj je još jedan potencijalni metoda kontrole. Prepoznavanje i liječenje inficiranih osoba, posebno asimptomatska pojedinci, će smanjiti veličinu rezervoara parazita unutar ljudske populacije i može smanjiti brzine prijenosa. Međutim, to može biti relativno skupo pristup.
Ovi pristupi se međusobno ne isključuju i mogu se kombinirati. Mnogi od uspješnih programa za kontrolu uključuju i mjere za kontrolu komaraca i liječenje zaraženih pojedinaca. Ne postoji standardna metoda kontrole malarije koja je dokazano univerzalno efikasan. U epidemiološke, socio-ekonomske, kulturne i infrastrukturnih faktora određenog regiona će odrediti najprikladnije kontrolu malarije. Neki od faktora koji se moraju uzeti u obzir uključuju:
- infrastrukture postojećih zdravstvenih usluga i druge resurse
- intenzitet i periodičnost (npr sezonalnost) prijenosa
- vrsta komaraca (ekološkim zahtjevima, karakteristike ponašanja, insekticid osjetljivost, itd)
- parazit vrsta i osjetljivost droge
- kulturne i društvene karakteristike stanovništva
- prisutnost socijalne i ekološke promjene
Kontrola malarije u tropskim Africi je posebno problematična zbog visoke stope prijenos i ukupni nizak socio-ekonomski nivo. Nekoliko studija je pokazalo da insekticid tretira bednets (ITBN) smanjiti morbiditet i mortalitet od malarije. U većini područja uvođenje bednets ne zahtijevaju velike promotivne programe i njihova upotreba je spremno prihvatili. Ovo može biti dijelom zbog smanjenja komaraca smetnja grize. Neka pitanja su postavljena u odnosu na ekonomsku održivost bednet programa. Potrebno je da se ponovno tretirati bednets sa insekticida povremeno i bednets treba popraviti i zamijenjen kada postanu poderanim i istrošiti. Osim toga, neki su izrazili zabrinutost zbog dugoročne koristi od bednets jer se smanjila izloženost, ali ga ne otkloni. Ovo smanjenje izloženosti može odgoditi sticanje imuniteta i jednostavno pospone morbiditeta i mortaliteta za starije dobne skupine.
[Pregled o kontroli malarije: R.S. Phillips (2001) Trenutni status malarije i potencijala za kontrolu. Clin. Microbiol. Otk 14: 208].
Dijagnoza
|
Malarija se sumnja kod osoba sa istorijom bio u endemska područja i simptomi u skladu sa malarijom (vidi kliničke manifestacije). Ovi simptomi, posebno u ranim fazama infekcije, su nespecifični i često opisuje kao gripu. Kako bolest napreduje, pacijent može pokazati uvećanu slezine i / ili jetre i anemije. Dijagnoza se potvrđuje mikroskopije. Debeli krv razmaza generalno osjetljiviji za otkrivanje parazita, dok su tanke mrlje su bolje za identifikaciju vrste. (Vidi krvi fazi morfologije Plasmodium vrsta.) Ako se paraziti ne nalaze na prvom krv razmaz se preporučuje da dodatne mrlje svakih 6-12 sati dok 48 sati. A okvirni dijagnoza P. falciparum (brojne i isključivo prsten faze) može predstavljati hitne medicinske pomoći, posebno u ne-imuni osoba. Rapid immunochromatographic ispitivanja (tj šipki) na osnovu otkrivanje antigena su također na raspolaganju (vidi pregled).
Hemoterapije i otpornost na lijek
Nekoliko malarije droge su na raspolaganju. Mnogi faktori su uključeni u odlučivanju na najbolji tretman za malariju. Ovi faktori uključuju parazita vrste, težine bolesti (npr., Komplikovano), starosti pacijenta i imunološkog statusa, podložnost parazita na droge (i.e., otpornost na lijek), a trošak i dostupnost droga. Stoga, tačan preporuke će često razlikuju po geografskom području. Osim toga, raznih droga postupa različito na različitim fazama životnog ciklusa (Tabela). Ostali linkovi interesa:
- Mehanizmi lijek akcije i otpora
- Virtualni Naval bolnicu, informacije o tretmanu i anti-malarials
- WHO, vodič na anti-malalarial korištenje
- Medicinski Pismo članak o drogama za parazitske infekcije.
| Odabrani Antimalarijski droge | ||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
Brzo-djelujući krvi schizontocides, koji djeluju na sceni krv parazita, koriste se za liječenje akutnih infekcija i brzo ublažavanje kliničkih simptoma. Hlorokin je uglavnom preporučeni tretman za pacijente sa P. vivax, P. ovale, P. malariae, i jednostavan hlorokin osjetljive P. falciparum infekcija. Hlorokin je siguran i obično dobro podnose. Nuspojave mogu uključivati svrbež (i.e., svrab), mučnina, ili agitacija. Pacijenti zaraženi ili P. vivax ili P. ovale, a da nisu na visokim rizikom za reinfekcije, treba tretirati sa primaquine (a schizontocide tkivo). Primaquine je efikasan protiv fazi jetre parazita, uključujući hypnozoites (vidi relapsa), i da će spriječiti buduće recidiva. Kombinacija hlorokin i primaquine se često naziva “radikalnim cure ‘.
Teška, ili komplikovano, falciparum malarije je ozbiljna bolest sa visokom stopom smrtnosti i mora se smatrati kao opasne po život, a time i zahtijeva hitno liječenje. Liječenje obično zahtijeva parenteralnu leka (i.e., injekcija) jer pacijenti su često u komi ili povraćanje, i na taj način ne može uzimati drogu usmeno. Parenteralne formulacije su dostupni za hlorokin, kinin, kinidin i artemisinin derivata. U artemisina derivati su općenito preferirani izbor, ali još nisu odobreni svuda. Na primjer, u Sjedinjenim Američkim Državama kinin i kinidin su odobreni lijekovi za teške malarije. Pacijenti trebaju biti kontinuirano pratiti hematokrita, parasitemia, nivo hidratacije, hipoglikemija, i znakovi toksičnosti droge i drugih komplikacija u toku liječenja. A prekidač za oralne primjene treba učiniti čim je pacijent u stanju. Većina smrtnih slučajeva zbog teške malarije javljaju u ili u blizini kuće u situacijama kada se pacijenti ne mogu se uzeti u bolnicu. Artemisinin čepići koji se može upravljati selo zdravstveni radnici su također razvili i pokazali su se sigurno i efikasno.
Efikasnost hlorokin je znatno umanjen za rasprostranjeno hlorokin otpor P. falciparum i pojava hlorokin otporna P. vivax. Ako hlorokin terapija nije efikasna, ili ako je u području sa hlorokin otporan malarija, zajednički alternativni tretmani uključuju: meflokvin, kinin u kombinaciji sa doksiciklin, ili Fansidar®. Derivati artemisinina (dihydroartemisinin, Artesunate i artemether) se sve više koristi u Aziji i Africi i sada preporučiti kao prva linija liječenja od strane Svjetske zdravstvene organizacije. Ovi lijekovi su originalno izvedeni iz pelina postrojenja (Artemesia annua) i korišteni su za dugo vremena u Kini kao biljni čaj se zove quinhaosu za liječenje febrilne bolesti. Kako bi se smanjila visoka ponovno izbijanje stope povezane sa artemisina derivata i usporiti razvoj rezistencije preporučuje se da liječenje biti u kombinaciji s nepovezanim protiv malarije. Lekovi koji se koriste u kombinaciji sa artemisina uključuju meflokvin, lumefantrin, Fansidar®, i amodiaquine.
Hemioprofilaksu. Hemioprofilaksa je posebno važno za osobe iz ne-malaričan područja koji posjećuju područja endemičnih za malariju. Takvi nisu imuni osobe mogu brzo razviti ozbiljne i po život opasne bolesti. Kao iu slučaju liječenja ne postoji standardna preporuka i izbore za hemioprofilaksu su jako ovisi o uvjetima u vezi s putovanja i indivdual osoba. (Vidi CDC Factsheet o sprječavanju malarije.) Hemioprofilaksa zahtijeva korištenje netoksičnih lijekova jer će se ovi lijekovi uzimaju u dužem vremenskom periodu. Općenito pacijent će početi da se lijek prije putovanja, a zatim nastaviti uzimanje droge tokom boravka u endemskom području i nastaviti uzimanje lijeka nakon povratka. Ovo je da osigura lijek se održava na dovoljno nivoima širom kroz posjete i za zaštitu protiv bilo kakve infekcije kojih se došlo tokom posjete. Na žalost, mnogi od efikasne i netoksični lijekova (npr hlorokin, primetamin, proquanil) su ograničene upotrebe zbog otpora droge. Druga strategija je vjerovatne (ili “standby”) tretman koji će se koristiti u kombinaciji sa profilaksi. U ovom slučaju osoba ili odustaje od profilaksa ili se hlorokin ili drugi relativno netoksični lijek za profilaksu i nosi droga poput Fansidar, meflokvin, ili kinin, koje će se, ako počnu da pokazuju simptome povezane s malarije.
Upotreba meflokvin za malarije hemioprofilaksu je pomalo kontroverzan. Meflokvin je efikasan u prevenciji malarije sa jednim radi tjedno, čime se nudi prednosti za drogu koja treba davati dnevno. Na ovom doza meflokvin se toleriše od strane većine pojedinaca. Međutim, neki ljudi doživljavaju neuropsihijatrijskih negativnih efekata kao što su poremećaji spavanja i noćne more. Ovo bi moglo biti pogoršano međunarodna putovanja koja je stresan događaj. Randomizirana, zaslijepljeni i kontrolisana ispitivanja pokazuju da neuropsihijatrijskih negativnih efekata su samo malo veći s meflokvin nego kod drugih antimalarici.
Ubijanje exoerythrocytic fazi (i.e., jetra) će spriječiti infekciju krvi i poznat je kao uzročna profilaksu. Ovo je vrlo poželjno u tome što ograničava količinu vremena treba uzeti prije profilaktičke droge i nakon putovanja u endemska područja. Jedini trenutno dostupan lijek za kauzalni profilaksu je primaquine. Međutim, malarije profilaksa nije odobrila korištenje primaquine i treba propisati samo za profilaksu od slučaja do slučaja. Na primjer, za osobe koje često imaju izlete kratkog trajanja do visoko endemskim područjima i da ta osoba ne pokazuje dehidrogenaze glukoza-6-fosfat. Tafenoquine je trenutno u fazi evaluacije polje za njegovu upotrebu u kauzalne profilaksu.
Komentari na liječenje malarije:
- Pasvol G (2006) Tretman komplikovane i teške malarije. Br Med Bull 75-76: 29-47.
- Newton P and White NJ (1999) Malarija: novi razvoj u liječenju i prevenciji. Annu Rev Med 50: 179.
- White NJ (1996) Tretman malarije. N Engl J Med 335: 800.
- White NJ (2008) Qinghaosu (Artemisinin): The Price of Success. Science 320, 330-334.
Otpornost na lijek
Otpor droge, a posebno, otpor hlorokin je veliki zdravstveni problem u kontroli malarije. otpor Drug je definisan neuspjeh tretmana i može se ocjenjuju u 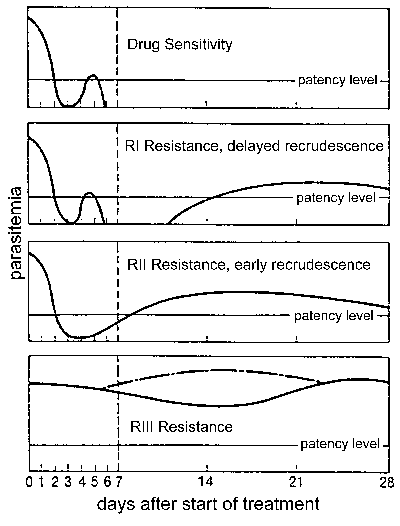 različitim nivoima ovisno o vremenu i ponovno izbijanje nakon liječenja (Slika). Tradicionalno ovih nivoa otpora droge su definirane kao osjetljive (bez ponovno izbijanje), RI (odloženo ponovno izbijanje), RII (rane ponovno izbijanje), i RIII (minimalne ili nikakve anti-parazit efekt). Modifikovana protokol na osnovu kliničke ishod je uvedena od strane SZO u 1996. U ovom protokolu razinu otpora izražava se kao adekvatan klinički odgovor (ACR), kasno neuspjeha liječenja (LTF), ili neuspjeh rano liječenje (ETF), kako je definisano je sledećim :
različitim nivoima ovisno o vremenu i ponovno izbijanje nakon liječenja (Slika). Tradicionalno ovih nivoa otpora droge su definirane kao osjetljive (bez ponovno izbijanje), RI (odloženo ponovno izbijanje), RII (rane ponovno izbijanje), i RIII (minimalne ili nikakve anti-parazit efekt). Modifikovana protokol na osnovu kliničke ishod je uvedena od strane SZO u 1996. U ovom protokolu razinu otpora izražava se kao adekvatan klinički odgovor (ACR), kasno neuspjeha liječenja (LTF), ili neuspjeh rano liječenje (ETF), kako je definisano je sledećim :
- ACR, odsustvo parasitemia (bez obzira na groznica) ili odsutnost kliničkih simptoma (bez obzira na parasitemia) na dan 14 od praćenja
- LTF, ponovno pojavljivanje simptoma ili prisustvo parasitemia tokom dana 4-14 praćenja
- ETF, upornost kliničkih simptoma u prisustvu parasitemia tokom prva 3 dana od praćenja
Ili protokol može se koristiti za određivanje otpornosti na lijek, ali protokol klinički ishod je više praktična u područjima intenzivne prenosa gdje to može biti teško razlikovati ponovne infekcije iz ponovno izbijanje i gdje parasitemia u odsustvu kliničkih simptoma je uobičajeno. otpor Drug bilo protokol određuje se in vivo testovima u kojima se u bolnici i pratiti bolesnika tijekom i nakon standardnog liječenja. Tu su i in vitro testova koji mogu procijeniti nivo otpornosti na lijek određivanjem efikasnost lijekova protiv P. falciparum uzgaja u kulturi (vidi Drug Resistance: malarije u WHO). In vivo i in vitro testovi ne odgovaraju uvijek od domaćina imunitet i drugi faktori mogu utjecati na in vivo rezultatima. Identifikacija specifičnih mutacija koja bi mogla biti povezana s otpornosti na lijek (vidi tabelu na drugi strani) također može dovesti do razvoja testova na osnovu molekularnih markera.
Otpor droge razvija kada droge su izabrani pod pritiskom droge parazita sa smanjenim osjetljivosti na malarije. Smanjena osjetljivost droge mogu biti dodijeljena po nekoliko mehanizama (vidi Mehanizmi otporг na droge) i odražava genetsku mutaciju (e) ili polimorfizama u parazita populacije. droga-otpor parazita u će imati selektivnu prednost u odnosu na parazite droge osjetljive na prisutnost droge i da će biti preferencijalno prenosi. Glavna faktora u razvoju rezistencije su korištenje subtherapeutic doza lijekova ili ne završetku režima liječenja (Tablica). Nižim nivoima droge će eliminirati najpodložniji parazita, ali i one koje mogu tolerirati droga će se oporaviti i razmnožavaju. Vremenom to će dovesti do nastavio izbor za parazite koji mogu tolerirati čak i veće doze lijeka. To je ključno za održavanje adekvatnog koncentracija lijeka za dovoljno vremena da u potpunosti eliminirati parazite iz bilo kog pojedinca.
| Faktori koji doprinose razvoju i širenje rezistencije |
||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
Otpor na Hlorokvin. Nakon predstavljanja pred kraj Drugog svjetskog rata, hlorokin brzo postao lijek izbora za liječenje i prevenciju malarije. Ne samo da je hlorokin efikasan lijek – vjerojatno zbog mjestu djelovanja u vakuole hrane i njenih uplitanja u formiranje hemozoin (vidi Akcija droge) – ali je relativno netoksičan i jeftino. Dva žarišta od hlorokin otporan P. falciparum su otkrivene u Kolumbiji i na granici Kambodže-Tajlandu tokom kasnih 1950-ih. Tokom 1960-ih i 1970-ih, otporan paraziti širi kroz Južnu Ameriku, jugoistočnoj Aziji, i Indija. Otpor je prvi put iskazani u istočnoj Africi 1978. godine i proširila cijelom kontinentu tokom 1980-ih godina. Hlorokin otporan P. vivax nije prijavljen do 1989. godine u Papua Nova Gvineja i sada naći u nekoliko žarišta u jugoistočnoj Aziji, a možda i Južnoj Americi.
Osnova otpora hlorokin se smanjuje akumulaciju hlorokin u parazita hrane vakuole. Osim toga, otpornost hlorokin može biti djelomično preokrenuti inhibitori P-glikoproteina (ABC transporter) koji su odgovorni za otpornost na više droga (MDR) u tumorskih ćelija, čime se ukazuje na slične pojave mogu javiti u Plasmodium. Mutacije u MDR-poput gen iz P. falciparum (Pfmdr1) su upleteni u otpor hlorokin. Međutim, ove mutacije nisu prediktivni otpora hlorokin u svim geografskim područjima. PfMDR1 Izgleda da doprinese stepen otpornosti hlorokin, ali samo to nije dovoljno da se daju otpor. Međutim, PfMDR1 se čini da igra ulogu u otpornosti na meflokvin i halofantrin i utječe na osjetljivost na artemisina.
Još jedan kandidat za genetskog lokusa otpora hlorokin je identifikovana putem genetske krst i mapiranje eksperiment. A 400 kb regija na hromozoma 7 je utvrđeno da odvoji na otpor hlorokin i dalje analize predložio da jedan gen, nazvan Pfcrt, bio odgovoran za otpornost hlorokin. Od ukupno 10 polimorfizama identifikovanih u ovom genu, samo jedan mutacija je perfectedly povezana sa otporom hlorokin fenotip. Ova mutacija dovodi do lizina na ostatak 76 se mijenja u treonin (K76T). Nekoliko studija na terenu su pokazale povezanost između Pfcrt-K76T i otpornost hlorokin koristeći i in vivo i in vitro metoda. Bilo je nedavno predložio da je bilo najmanje 4 osnivač mutacija u genu Pfcrt povezane sa različitim geografskim regijama Azija / Afrika, Papua Nova Gvineja, Brazil / Peru, i Kolumbija (Wootton et al, Nature 418: 320, 2002) . Pretpostavlja se korištenje hlorokin rezultiralo kasnijim izbor i širenje fenotipa otporan.
Komentari na otpor droge:
- Boland PB (2001) Otpornost na droge u malarije. WHO/CDS/CSR/DRS/2001.4
- Hyde JE (2007) Drug-otporan malarije – uvid. FEBS Journal 274, 4688-4698.
- Warhust D (2001) Novi razvoj: hlorokin otpora u Plasmodium falciparum. Drug Resistance Updates 4: 141.
- Wellems TE i plowe CV (2001) hlorokin otporan malarije. J Inf Dis 184: 770.
- Wongsrichanalai C, Pickard AL, Wernsdorfer WH i Meshnick SR (2002) Epidemiologija malarije rezistentne. Lancet lnfect Dis 2: 209.
LINKOVI
- Vrh
- Životni ciklus
- Kliničke manifestacije
- Patogeneza i cerebralne malarije
- Cytoadherence Mehanizam (PfEMP-1)
- Epidemiologija
- Prevencija i kontrola
- Dijagnoza
- Hemoterapije i odpor an lijek
- Odpor an lijek
- Akcija lijek i mehanizmi rezistencije (posebnoj stranici)
- Protozoologija Home
- Studija vodiče
- Nastavni plan
- Ostali kursevi i predavanja
- Wiser Home
- Other Internet Sites